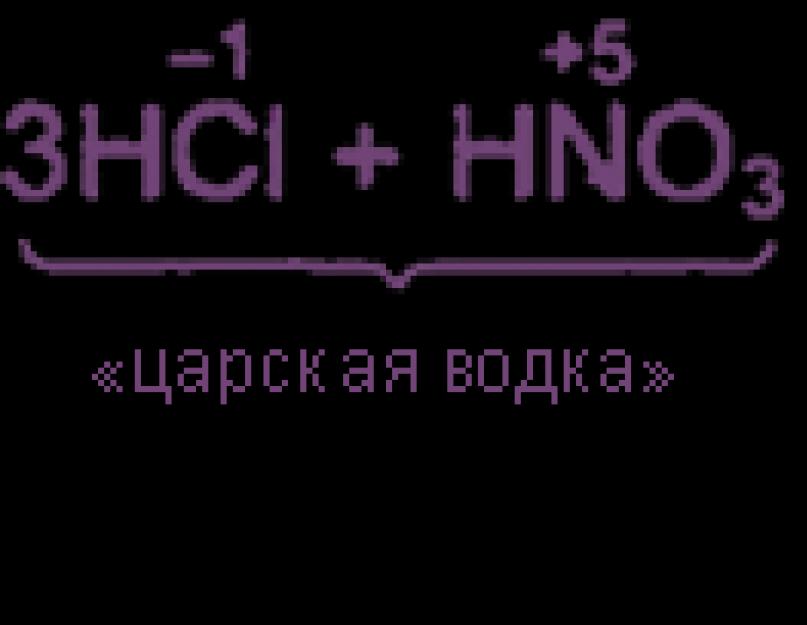Cl 2 при об. Т - газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха - в 2,5 раза, малорастворим в воде (~ 6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Способы получения
Основаны на процессе окисления анионов Cl -
2Cl - - 2e - = Cl 2 0
Промышленный
Электролиз водных растворов хлоридов, чаще - NaCl:
2NaCl + 2Н 2 O = Cl 2 + 2NaOH + H 2
Лабораторные
Окисление конц. HCI различными окислителями:
4HCI + MnO 2 = Cl 2 + МпCl 2 + 2Н 2 O
16НСl + 2КМпО 4 = 5Cl 2 + 2MnCl 2 + 2KCl + 8Н 2 O
6HCl + КСlO 3 = ЗCl 2 + KCl + 3Н 2 O
14HCl + К 2 Сr 2 O 7 = 3Cl 2 + 2CrCl 3 + 2KCl + 7Н 2 O
Химические свойства
Хлор - очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl - :
Cl 2 0 + 2e - = 2Cl -
Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Cl 2 + 2Na = 2NaCl
3Cl 2 + 2Fe = 2FeCl 3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Cl 2 + Сu = CuCl 2
3Cl 2 + 2Аu = 2AuCl 3
Реакции с неметаллами
Хлор непосредственно не взаимодействует только с O 2 , N 2 , С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Cl 2 + Н 2 =2НС1
Cl 2 + 2S (расплав) = S 2 Cl 2
ЗCl 2 + 2Р = 2РCl 3 (или РCl 5 - в избытке Cl 2)
2Cl 2 + Si = SiCl 4
3Cl 2 + I 2 = 2ICl 3
Вытеснение свободных неметаллов (Вr 2 , I 2 , N 2 , S) из их соединений
Cl 2 + 2KBr = Br 2 + 2KCl
Cl 2 + 2KI = I 2 + 2KCl
Cl 2 + 2HI = I 2 + 2HCl
Cl 2 + H 2 S = S + 2HCl
ЗСl 2 + 2NH 3 = N 2 + 6HCl
Диспропорционирование хлора в воде и водных растворах щелочей
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl - , а другие в положительной степени окисления входят в состав анионов ClO - или ClO 3 - .
Cl 2 + Н 2 O = HCl + НClO хлорноватистая к-та
Cl 2 + 2КОН =KCl + KClO + Н 2 O
3Cl 2 + 6КОН = 5KCl + KClO 3 + 3Н 2 O
3Cl 2 + 2Са(ОН) 2 = CaCl 2 + Са(ClO) 2 + 2Н 2 O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO 3 и Са(ClO) 2 - гипохлориты; КClO 3 - хлорат калия (бертолетова соль).
Взаимодействие хлора с органическими веществами
а) замещение атомов водорода в молекулах ОВ
б) присоединение молекул Cl 2 по месту разрыва кратных углерод-углеродных связей
H 2 C=CH 2 + Cl 2 → ClH 2 C-CH 2 Cl 1,2-дихлорэтан
HC≡CH + 2Cl 2 → Cl 2 HC-CHCl 2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
Газообразный хлороводород
Физические и химические свойства
HCl - хлорид водорода. При об. Т - бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F 2 = Сl 2 + 2HF
4HCl + O 2 = 2Сl 2 + 2Н 2 O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
Способы получения
1. Синтез из простых веществ:
Н 2 + Cl 2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl 2 = R-Cl + HCl
3. В лаборатории получают действием конц. H 2 SO 4 на хлориды:
H 2 SО 4 (конц.) + NaCl = 2HCl + NaHSО 4 (при слабом нагревании)
H 2 SО 4 (конц.) + 2NaCl = 2HCl + Na 2 SО 4 (при очень сильном нагревании)
Водный раствор HCl - сильная кислота (хлороводородная, или соляная)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н 2 O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
Химические свойства соляной кислоты
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
HCl → H + + Cl -
Взаимодействие:
а) с металлами (до Н):
2HCl 2 + Zn = ZnCl 2 + H 2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl 2 + Н 2 O
6HCl + Аl 2 O 3 = 2АlCl 3 + ЗН 2 O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН) 2 = CaCl 2 + 2Н 2 О
3HCl + Аl(ОН) 3 = АlСl 3 + ЗН 2 O
г) с солями более слабых кислот:
2HCl + СаСО 3 = CaCl 2 + СO 2 + Н 3 O
HCl + C 6 H 5 ONa = С 6 Н 5 ОН + NaCl
д) с аммиаком:
HCl + NH 3 = NH 4 Cl
Реакции с сильными окислителями F 2 , MnO 2 , KMnO 4, KClO 3, K 2 Cr 2 O 7 . Анион Cl - окисляется до свободного галогена:
2Cl - - 2e - = Cl 2 0
Уравнения реакция см. "Получение хлора". Особое значение имеет ОВР между соляной и азотной кислотами:

Реакции с органическими соединениями
Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH 2 + HCl → + Cl -
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислотные оксиды

Кислоты

Соли
Химические свойства
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.

Хлорная известь
Хлорная (белильная) известь - смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H 2 O
Министерство образования и науки РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное ГОСУДАРСТВЕННОЕ бюджетное ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
ИВАНОВСКИЙ ГОСУДАРСТВЕННЫЙ ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра ТП и МЭТ
Реферат
Хлор: свойства, применение, получение
Руководитель: Ефремов А.М.
Иваново 2015
Введение
Общие сведения по хлору
Применение хлора
Химические способы получения хлора
Электролиз. Понятие и сущность процесса
Промышленное получение хлора
Техника безопасности в хлорном производстве и охрана окружающей среды
Заключение
Введение
хлор химический элемент электролиз
В связи с масштабностью применения хлора в различных областях науки, промышленности, медицины и в быту, спрос на него в последнее время катастрофически возрос. Существует множество методик получения хлора лабораторными и промышленными методами, однако все они имеют больше недостатков, чем достоинств. Получение хлора, например, из соляной кислоты, являющейся побочным продуктом и отходом множества химических и иных производств или поваренной соли, добываемой в соляных месторождениях, процесс достаточно энергозатратный, вредный с точки зрения экологии и весьма опасный для жизни и здоровья.
В настоящее время весьма актуальна проблема разработки технологии получения хлора, которая исключала бы все вышеизложенные недостатки, а также обладала высоким выходом по хлору.
.Общие сведения по хлору
Хлор получен впервые в 1774 году К. Шееле взаимодействием соляной кислоты с пиролюзитом MnО2. Однако только в 1810 году Г. Дэви установил, что хлор - элемент и назвал его chlorine (от греч. chloros - желто-зеленый). В 1813 году Ж. Л. Гей-Люссак предложил для этого элемента название «Хлор».
Хлор - элемент VII группы периодической системы элементов Д. И. Менделеева. Молекулярная масса 70,906, атомная масса 35,453, атомный номер - 17, относится к семейству галогенов. При нормальных условиях свободный хлор, состоящий из двухатомных молекул, представляет собой зеленовато-желтый негорючий газ с характерным резким и раздражающим запахом. Он ядовит и вызывает удушье. Сжатый газообразный хлор при атмосферном давлении превращается в жидкость янтарного цвета при -34,05 °С, затвердевает при -101,6 °С и давлении 1 атм. Обычно хлор представляет собой смесь 75,53% 35Cl и 24,47% 37Cl. При нормальных условиях плотность газообразного хлора составляет 3,214 кг/м3, то есть он примерно в 2,5 раза тяжелее воздуха.
Химически хлор очень активен, непосредственно соединяется почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании) и с неметаллами (кроме углерода, азота, кислорода, инертных газов), образуя соответствующие хлориды, вступает в реакцию со многими соединениями, замещает водород в предельных углеводородах и присоединяется к ненасыщенным соединениям. Этим обусловлено большое разнообразие его применения. Хлор вытесняет бром и иод из их соединений с водородом и металлами. Щелочные металлы в присутствии следов влаги взаимодействуют с хлором с воспламенением, большинство металлов реагирует с сухим хлором только при нагревании. Сталь, а также некоторые металлы стойки в атмосфере сухого хлора в условиях невысоких температур, поэтому их используют для изготовления аппаратуры и хранилищ для сухого хлора. Фосфор воспламеняется в атмосфере хлора, образуя РCl3, а при дальнейшем хлорировании - РСl5. Сера с хлором при нагревании дает S2Cl2, SCl2 и другие SnClm. Мышьяк, сурьма, висмут, стронций, теллур энергично взаимодействуют с хлором. Смесь хлора с водородом горит бесцветным или желто-зеленым пламенем с образованием хлористого водорода (это цепная реакция). Максимальная температура водородно-хлорного пламени 2200°С. Смеси хлора с водородом, содержащие от 5,8 до 88,5% Н2, взрывоопасны и могут взрываться от действия света, электрической искры, нагревания, от присутствия некоторых веществ, например оксидов железа.
С кислородом хлор образует оксиды: Cl2О, СlO2, Cl2О6, Сl2О7, Cl2О8, а также гипохлориты (соли хлорноватистой кислоты), хлориты, хлораты и перхлораты. Все кислородные соединения хлора образуют взрывоопасные смеси с легко окисляющимися веществами. Оксиды хлора малостойки и могут самопроизвольно взрываться, гипохлориты при хранении медленно разлагаются, хлораты и перхлораты могут взрываться под влиянием инициаторов. Хлор в воде гидролизуется, образуя хлорноватистую и соляную кислоты: Cl2 + Н2О? НClО + НCl. Образующийся желтоватый раствор часто называют хлорной водой. При хлорировании водных растворов щелочей на холоду образуются гипохлориты и хлориды: 2NaOH + Cl2= NaClO + NaCl + Н2О, а при нагревании - хлораты. Хлорированием сухого гидрооксида кальция получают хлорную известь. При взаимодействии аммиака с хлором образуется треххлористый азот. При хлорировании органических соединений хлор либо замещает водород, либо присоединяется по кратным связям, образуя различные хлорсодержащие органических соединения. С других галогенами хлор образует межгалогенные соединения. Фториды хлора ClF, ClF3, ClF3 очень реакционноспособны; например, в атмосфере ClF3 стеклянная вата самовоспламеняется. Известны соединения хлора с кислородом и фтором - оксифториды хлора: ClO3F, ClO2F3, ClOF, ClOF3 и перхлорат фтора FClO4.
Хлор встречается в природе только в виде соединений. Среднее содержание его в земной коре 1,7·10-2% по массе. Основную роль в истории хлора в земной коре играет водная миграция. В виде иона Cl- он содержится в Мировом океане (1,93%), подземных рассолах и соляных озерах. Число собственных минералов (преимущественно природных хлоридов) 97, главный из них галит NaCl (Каменная соль). Известны также крупные месторождения хлоридов калия и магния и смешанных хлоридов: сильвин КCl, сильвинит (Na,K)Cl, карналит KCl·MgCl2·6H2O, каинит KCl·MgSO4·3H2O, бишофит MgCl2·6H2O. В истории Земли большое значение имело поступление содержащегося в вулканических газах НCl в верхние части земной коры.
Стандарты качества хлора
Наименование показателя ГОСТ 6718-93Высший сортПервый сортОбъемная доля хлора, не менее, %99,899,6Массовая доля воды, не более, %0,010,04Массовая доля треххлористого азота, не более, %0,0020,004Массовая доля нелетучего остатка, не более, %0,0150,10
Хранение и транспортировка хлора
Производимый всевозможными методами хлор хранится в специальных «танках» или закачивается в стальные цилиндрические (объёмом 10-250 м3) и шаровые (объёмом 600-2000 м3) баллоны под давлением собственных паров 18 кгс/см2. Максимальные объемы хранения составляют 150 тонн. Баллоны с жидким хлором под давлением имеют специальную окраску - защитный цвет. В случае разгерметизации баллона с хлором происходит резкий выброс газа с концентрацией, превышающей смертельную в несколько раз. Следует отметить, что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота. Перевозят хлор в контейнерах, железнодорожных цистернах, баллонах, которые являются временным его хранилищем.
2.Применение хлора
Хлор потребляется прежде всего химической промышленностью для производства различных органических хлорпроизводных, идущих для получения пластических масс, синтетических каучуков, химических волокон, растворителей, инсектицидов и т.п. В настоящее время более 60% мирового производства хлора используется для органического синтеза. Помимо этого хлор используют для производства соляной кислоты, хлорной извести, хлоратов и других продуктов. Значительные количества хлора идут в металлургию для хлорирования при переработке полиметаллических руд, извлечения золота из руд, а также его используют в нефтеперерабатывающей промышленности, в сельском хозяйстве, в медицине и санитарии, для обезвреживания питьевой и сточных вод, в пиротехнике и ряде других областей народного хозяйства. В результате развития сфер использования хлора, главным образом благодаря успехам органического синтеза, мировое производство хлора составляет более 20 млн. т/год.
Основные примеры применения и использования хлора во всевозможных отраслях науки, промышленности и бытовых нужд:
1.в производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан .
CH2=CH2+Cl2=>CH2Cl-CH2ClCl-CH2Cl=> CH2=CHCl+HCl
1)в качестве отбеливающего средства (хотя не сам хлор «отбеливает», а атомарный кислород, который образуется при распаде хлорноватистой кислоты по реакции: Cl2 + H2O ? HCl + HClO ? 2HCl + O*).
2)в производстве хлорорганических инсектицидов - веществ, убивающих вредных для посевов насекомых, но безопасных для растений (альдрин, ДДТ, гексахлоран). Один из самых важных инсектицидов - гексахлорциклогексан (C6H6Cl6).
)используется как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт (C4H8Cl2S), фосген (CCl2O).
)для обеззараживания воды - «хлорирования». Наиболее распространённый способ обеззараживания питьевой воды основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов катализирующие окислительно-восстановительные процессы . Для обеззараживания питьевой воды применяют: хлор (Cl2), двуокись хлора (ClO2), хлорамин (NH2Cl) и хлорную известь (Ca(Cl)OCl).
)в пищевой промышленности зарегистрирован в качестве пищевой добавки E925.
)в химическом производстве каустической соды (NaOH) (применяется в производстве искусственного шелка, в мыловаренной промышленности), соляной кислоты (HCl), хлорной извести, бертолетовой соли (KClO3), хлоридов металлов, ядов, лекарств, удобрений.
)в металлургии для производства чистых металлов: титана, олова, тантала, ниобия .
TiO2 + 2C + 2Cl2 => TiCl4 + 2CO;
TiCl4 + 2Mg => 2MgCl2 + Ti (при Т=850°С)
)в качестве индикатора солнечных нейтрино в хлор-аргонных детекторах (Идея «хлорного детектора» для регистрации солнечных нейтрино была предложена известным советским физиком академиком Б. Понтекорво и осуществлена американским физиком Р. Девисом и его сотрудникми. Уловив нейтрино ядро изотопа хлора с атомным весом 37, превращается в ядро изотопа аргона-37, при этом образуется один электрон, который можно зарегистрировать.).
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов (глобальные экотоксиканты, обладающие мощным мутагенным
3.Химические способы получения хлора
Ранее было распространено производство хлора химическим путем по способам Вельдона и Дикона. В этих процессах хлор получали окислением хлористого водорода, образовывающегося в качестве побочного продукта в производстве сульфата натрия из поваренной соли действием серной кислоты.
реакция протекающая при использовании метода Вельдона:
4НСl + МnO2 =>МnСl2+ 2Н2O + Сl2
реакция протекающая при использовании метода Дикона:
НСl + O2 =>2Н2O + 2Сl2
В диконовском процессе в качестве катализатора использовали хлорную медь, 50%-ным раствором которой (иногда с добавкой NaCl) пропитывали пористый керамический носитель. Оптимальная температура реакции на таком катализаторе была обычно в пределах 430490°. Этот катализатор легко отравляется соединениями мышьяка, с которыми образует неактивный арсенат меди, а также двуокисью и трехокисью серы. Присутствие в газе даже небольших количеств паров серной кислоты вызывает резкое уменьшение выхода хлора в результате последовательно идущих реакций:
H2SO4 => SO2 + 1/2O2 + H2O+ С12 + 2Н2O => 2НCl + H2SO4
С12 + Н2O => 1/2O2 + 2НСl
Таким образом, серная кислота является катализатором, способствующим обратному превращению Сl2 в НСl. Поэтому хлористоводородный газ до окисления на медном катализаторе должен подвергаться тщательной очистке от примесей, снижающих выход хлора.
Установка Дикона состояла из подогревателя газа, газового фильтра и контактного аппарата стального цилиндрического кожуха, внутри которого находились два концентрически расположенных керамических цилиндра с отверстиями; кольцевое пространство между ними заполнено катализатором. Хлористый водород окисляли воздухом, поэтому хлор получался разбавленным. В контактный аппарат подавали смесь, содержавшую 25 объемн.% НСl и 75 объемн.% воздуха (~16% O2), а газ, выходивший из аппарата, содержал около 8% С12, 9% НСl, 8% водяного пара и 75% воздуха. Такой газ, после отмывки из него НСl и осушки серной кислотой, использовали обычно для получения хлорной извести.
Реставрация процесса Дикона в настоящее время базируется на окислении хлористого водорода не воздухом, а кислородом, что позволяет получать концентрированный хлор при применении высокоактивных катализаторов. Образующуюся хлорокислородную смесь отмывают от остатков НС1 последовательно 36- и 20%-ной соляной кислотой и осушают серной кислотой. Затем хлор сжижают, а кислород возвращают в процесс. Отделение хлора от кислорода производят также, поглощая хлор под давлением 8 атм хлористой серой, которую затем регенерируют, получая 100%-ный хлор:
Сl2 + S2CI2
Используют низкотемпературные катализаторы, например, двухлористую медь, активированную солями редкоземельных металлов, что дает возможность вести процесс даже при 100°С и поэтому резко увеличить степень превращения НСl в Сl2. На окисно-хромовом катализаторе сжигание НСl в кислороде производят при 340480°C. Описано применение при 250420°C катализатора из смеси V2O5 с пиросульфатами щелочных металлов и активаторами на силикагеле. Изучены механизм и кинетика этого процесса и установлены оптимальные условия его осуществления, в частности в псевдоожиженном слое.
Окисление хлористого водорода кислородом производят также с помощью расплавленной смеси FeCl3 + КСl в две стадии, осуществляемые в отдельных реакторах. В первом реакторе происходит окисление хлорного железа с образованием хлора:
2FeCl3 + 1
Во втором реакторе хлорное железо регенерируется из окиси железа хлористым водородом:
O3 + 6HCI = 2FeCl3 + 3H20
Для уменьшения давления пара хлорного железа добавляют хлористый калий. Этот процесс предложено осуществлять также в одном аппарате, в котором контактная масса, состоящая из Fe2O3, КС1 и хлорида меди, кобальта или никеля, нанесенных на инертный носитель, перемещается сверху вниз аппарата. Вверху аппарата она проходит горячую зону хлорирования, где Fe2Оз превращается в FeCl3, взаимодействуя с НСl, находящимся в потоке идущего снизу вверх газа. Затем контактная масса опускается в зону охлаждения, где под действием кислорода образуется элементарный хлор, a FeCl3 переходит в Fe2O3. Окисленная контактная масса снова возвращается в зону хлорирования.
Подобное же косвенное окисление НСl в Cl2 осуществляется по схеме:
2НС1 + MgО = MgCl2 + Н2O
Предложено одновременно получать хлор и серную кислоту, пропуская через ванадиевый катализатор при 400600°C газ, содержащий НСl, O2 и большой избыток SO2. Затем из газа конденсируют H2SO4 и HSO3Cl и абсорбируют SO3 серной кислотой хлор остается в газовой фазе. HSO3Cl гидролизуется и выделяющийся НС1 возвращают в процесс.
Еще более эффективно окисление проводится такими окислителями, как РbО2, КМnО4, КСlO3, К2Сr2О7 :
2KMnO4 + 16HCl => 2KCl + 2MnCl2 + 5Cl2^ +8H2O
Хлор может быть получен и окислением хлоридов. Например, при взаимодействии NaCl и SO3 идут реакции:
NaCl + 2SO3 = 2NaSO3Cl
NaSO3Cl = Cl2 + SO2 + Na2SO4
Распад NaSO3Cl происходит при 275°C. Смесь газов SO2 и С12 можно разделить, поглощая хлор SO2Cl2 или ССl4 или подвергая ее ректификации, в результате которой получается азеотропная смесь, содержащая 88 мол. % Cl2 и 12 мол. % SO2. Азеотропную смесь можно далее разделить, переводя SO2 в SO2C12 и отделяя избыточный хлор, a SO2Cl2 разлагая при 200° на SO2 и Сl2, которые добавляют к смеси, направляемой на ректификацию.
Хлор можно получить окислением хлорида или хлористого водорода азотной кислотой, а также двуокисью азота:
ЗНСl + HNO3 => Сl2 + NOCl + 2Н2O
Ещё один способ получения хлора - разложение хлористого нитрозила, которое может быть достигнуто его окислением:
NOCl + O2 = 2NO2 + Сl2
Также для получения хлора предложено, например, окислять NOCl 75%-ной азотной кислотой:
2NOCl + 4HNO3 = Сl2 + 6NO2 + 2Н2O
Смесь хлора и двуокиси азота разделяют, перерабатывая NO2 в слабую азотную кислоту, используемую затем для окисления НСl в первой стадии процесса с образованием Сl2 и NOCl. Основным затруднением при осуществлении этого процесса в промышленных масштабах является устранение коррозии. В качестве материалов для аппаратуры применяют керамику, стекло, свинец, никель, пластмассы. По этому методу в США в 19521953 гг. работала установка производительностью 75 т хлора в сутки.
Разработан циклический способ получения хлора окислением хлористого водорода азотной кислотой без образования хлористого нитрозила по реакции:
2НСl + 2HNO3 = Сl2 + 2NO2 + 2Н2O
Процесс идет в жидкой фазе при 80°C, выход хлора достигает 100%, NO2 получается в жидком виде.
В последствии эти способы были полностью вытеснены электрохимическими, но в настоящее время химические способы получения хлора вновь возрождаются на новой технической базе. Все они основаны на прямом или косвенном окислении HCl (или хлоридов), причем наиболее распространенным окислителем является кислород воздуха.
Электролиз. Понятие и сущность процесса
Электролиз - совокупность электрохимических окислительно-восстановительных процессов, которые происходят на электродах во время прохождения постоянного электрического тока через расплав или раствор с погруженными в него электродами.
Рис. 4.1. Процессы, протекающие при электролизе. Схема электролизной ванны: 1 - ванна, 2 - электролит, 3 - анод, 4 - катод, 5 - источник питания
Электродами могут служить любые материалы, проводящие электрический ток. В основном применяют металлы и сплавы, из неметаллов электродами могут служить, например, графитовые стержни (или углерод). Реже в качестве электрода используют жидкости. Электрод, заряженный положительно - анод. Электрод, заряженный отрицательно - катод. При электролизе происходит окисление анода (он растворяется) и восстановление катода. Именно поэтому анод следует брать таким, чтобы его растворение не повлияло на химический процесс, протекающий в растворе или расплаве. Такой анод называют инертным электродом. В качестве инертного анода можно взять графит (углерод) или платину. В качестве катода можно взять металлическую пластину (она не будет растворяться). Подойдёт медь, латунь, углерод (или графит), цинк, железо, алюминий, нержавейка.
Примеры электролиза расплавов:
Примеры электролиза растворов солей:
(на аноде окисляются анионы Сl?, а не кислород O?II молекул воды, так как электроотрицательность хлора меньше, чем кислорода, и следовательно, хлор отдает электроны легче, чем кислород)
Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита - воды):
В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде. При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (например Li+, Cs+, K+, Ca2+, Na+, Mg2+, Al3+) и никогда не окисляется на аноде кислород O?II анионов оксокислот с элементом в высшей степени окисления (например ClO4?, SO42?, NO3?, PO43?, CO32?, SiO44?, MnO4?), вместо них окисляется вода.
Электролиз включает два процесса: миграцию реагирующих частиц под действием электрического поля к поверхности электрода и переход заряда с частицы на электрод или с электрода на частицу. Миграция ионов определяется их подвижностью и числами переноса. Процесс переноса нескольких электрических зарядов осуществляется, как правило, в виде последовательности одноэлектронных реакций, то есть постадийно, с образованием промежуточных частиц (ионов или радикалов), которые иногда существуют некоторое время на электроде в адсорбированном состоянии .
Скорости электродных реакций зависят от:
состава электролита
концентрации электролита
материала электродов
электродного потенциала
температуры
гидродинамических условий.
Мерой скорости реакций служит плотность тока. Это векторная физическая, модуль которой определяется соотношением силы тока (количество переносимых электрических зарядов в единицу времени) в проводнике к площади поперечного сечения.
Законы электролиза Фарадея являются количественными соотношениями, основанными на электрохимических исследованиях, и помогают определить массу образующихся при электролизе продуктов. В наиболее общем виде законы формулируются следующим образом:
)Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
2)Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество .
В математическом виде законы Фарадея можно представить следующим образом:
где m - масса осаждённого на электроде вещества в граммах,- полный электрический заряд, прошедший через вещество,= 96 485,33(83) Кл·моль?1 - постоянная Фарадея,- молярная масса вещества (Например, молярная масса воды H2O = 18 г/моль),- валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z - это эквивалентная масса осаждённого вещества.
Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m.
Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
В простейшем случае постоянного тока электролиза приводит к:
В более сложном случае переменного электрического тока полный заряд Q тока I(?) суммируется за время ? :
где t - полное время электролиза.
В промышленности процесс электролиза проводится в специальных аппаратах - электролизерах.
Промышленное получение хлора
В настоящее время хлор, главным образом, производят электролизом водных растворов, а именно одним из
Сырьем для электролитического производства хлора служат, главным образом, растворы поваренной соли NaCl, получаемые растворением твердой соли, или же природные рассолы. Имеются три типа месторождений соли: ископаемая соль (около 99% запасов); соляные озера с донными отложениями самосадочной соли (0,77%); остальное - подземные расколы. Растворы поваренной соли независимо от пути их получения содержат примеси, ухудшающие процесс электролиза. Особо неблагоприятное влияние при электролизе с твёрдым катодом оказывают катионы кальция Ca2+, Mg2+ и анионы SO42- , а при электролизе с жидким катодом - примеси соединений, содержащих тяжелые металлы, например хром, ванадий, германий и молибден.
Кристаллическая соль для хлорного электролиза должна иметь следующий состав (%): хлорид натрия не менее 97,5; Mg2+ не более 0,05; нерастворимого осада не более 0,5; Ca2+ не более 0,4; K+ не более 0,02; SO42- не более 0,84; влажность не более 5; примесь тяжелых металлов (определяемая амальгамной пробой см3 H2) не более 0,3. Очистка рассолов производится раствором соды (Na2CO3) и известковым молоком (взвесь суспензии Ca(OH)2 в воде). Помимо химической очистки, растворы освобождаются от механических примесей отстаиванием и фильтрацией.
Электролиз растворов поваренной соли производится в ваннах с твердым железным (или стальным) катодом и с диафрагмами и мембранами, в ваннах с жидким ртутным катодом. Промышленные электролизеры, применяемые для оборудования современных крупных хлорных цехов, должны иметь высокую производительность, простую конструкцию, быть компактными, работать надежно и устойчиво.
Электролиз протекает по схеме:
MeCl + H2O => MeOH + Cl2 + H2,
где Me щелочной металл.
При электрохимическом разложении поваренной соли в электролизерах с твердыми электродами протекают следующие основные, обратимые и необратимые ионные реакции:
диссоциация молекул поваренной соли и воды (идет в электролите)
NaCl-Na++Cl-
Окисление иона хлора (на аноде)
С1- - 2е- => С12
восстановление иона водорода и молекул воды (на катоде)
Н+ - 2е- => Н2
Н2O - 2е - => Н2 + 2OН-
Ассоциация ионов в молекулу гидроксида натрия (в электролите)
Na+ + OH- - NaOH
Полезными продуктами являются гидроксид натрия, хлор и водород. Все они выводятся из электролизера раздельно.
Рис. 5.1. Схема диафрагменного электролизера
Полость электролизера с твердым катодом (рис. 3) разделена пористой
Первые промышленные электролизеры работали в периодическом режиме. Продукты электролиза в них разделялись цементной диафрагмой. В дальнейшем были созданы электролизеры, в которых для разделения продуктов электролиза служили перегородки в виде колокола. На следующем этапе появились электролизеры с проточной диафрагмой. В них принцип противотока объединялся с использованием разделительной диафрагмы, которую изготавливали из асбестового картона. Далее был открыт способ получения диафрагмы из асбестовой пульпы, заимствованный из технологии бумажной промышленности. Этот способ позволил разработать конструкции электролизеров на большую токовую нагрузку с неразборным компактным пальцевым катодом. Для увеличения срока службы асбестовой диафрагмы предложено в ее состав вводить в качестве покрытия или связи некоторые синтетические материалы. Предложено также диафрагмы целиком изготовлять из новых синтетических материалов. Имеются данные, что такие комбинированные асбосинтетические или специально изготовленные синтетические диафрагмы имеют срок службы до 500 суток. Разрабатываются также специальные ионообменные диафрагмы, которые позволяют получать чистую каустическую соду с очень малым содержанием хлорида натрия. Действие таких диафрагм основано на использовании их селективных свойств для прохождения различных ионов.
Места контактов токоподводов к графитовым анодам в ранних конструкциях выносили из полости электролизера наружу. В дальнейшем были разработаны способы защиты контактных частей анодов, погруженных в электролит. С использованием этих технических приемов были созданы промышленные электролизеры с нижним токоподводом, в которых анодные контакты располагаются в полости электролизера. Они и применяются повсеместно в настоящее время для производства хлора и каустика на твердом катоде.
В анодное пространство диафрагменного электролизера непрерывно поступает поток насыщенного раствора поваренной соли (очищенного рассола). В результате электрохимического процесса на аноде за счет разложения поваренной соли выделяется хлор, а на катоде за счет разложения воды - водород. Хлор и водород выводятся из электролизера, не смешиваясь, раздельно. При этом прикатодная зона обогащается гидроксидом натрия. Раствор из прикатодной зоны, называемый электролитическим щелоком, содержащий неразложившуюся поваренную соль (приблизительно половину от поданного с рассолом количества) и гидроксид натрия, непрерывно выводится из электролизера. На следующей стадии электролитический щелок упаривают и доводят содержание в нем NaOH до 42- 50% в соответствии со стандартом. Поваренная соль и сульфат натрия при повышении концентрации гидроксида натрия выпадают в осадок.
Раствор NaOH декантируют от кристаллов и передают в качестве готового продукта на склад или на стадию плавки каустика для получения твердого продукта. Кристаллическую поваренную соль (обратную соль) возвращают на электролиз, приготавливая из нее так называемый обратный рассол. Из него во избежание накапливания сульфата в растворах перед приготовлением обратного рассола извлекают сульфат. Убыль поваренной соли возмещают добавкой свежего рассола, полученного подземным выщелачиванием соляных пластов или растворением твердой поваренной соли. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния. Полученный хлор отделяется от паров воды, компримируется и передается либо непосредственно потребителям, либо на сжижение хлора. Водород отделяется от воды, компримируется и передается потребителям.
В мембранном электролизере протекают те же химические реакции, что и в диафрагменном электролизере. Вместо пористой диафрагмы используют катионную мембрану (Рис. 5).
Рис. 5.2. Схема мембранного электролизера
Мембрана препятствует проникновению ионов хлора в католит (электролит в катодном пространстве), за счет чего непосредственно в электролизере можно получить каустическую соду почти без соли, концентрацией от 30 до 35%. Поскольку исчезает необходимость отделять соль, выпаривание обеспечивает получение 50%-ной коммерческой каустической соды значительно проще и при меньших капиталовложениях и энергозатратах. Поскольку каустическая сода в мембранном процессе значительно большей концентрации, то в качестве катода используют дорогостоящий никель.
Рис. 5.3. Схема ртутного электролизера
Суммарная реакция разложения поваренной соли в ртутных электролизерах такая же, как и в диафрагменных:
NaCl+Н2O => NaOH + 1/2Сl2+ 1/2Н2
Однако здесь она проходит в две стадии и каждая в отдельном аппарате: электролизере и разлагателе. Они конструктивно объединены между собой и называются электролитической ванной, а иногда ртутным электролизером.
На первой стадии процесса - в электролизере - проходит электролитическое разложение поваренной соли (в электролизер подается ее насыщенный раствор) с получением на аноде хлора, а на ртутном катоде - амальгамы натрия, по следующей реакции:
NaCl + nHg => l/2Cl2 + NaHgn
В разлагателе проходит вторая стадия процесса, в который под действием воды амальгама натрия переходит в гидроксид натрия и ртуть:
NaHgn + Н2O => NaOH +1/2H2+nHg
Из всей соли, поданной в электролизер с рассолом, в реакцию (2) вступает лишь 15-20% от поданного количества, а остальная соль вместе с водой выходит из электролизера в виде хлоранолита - раствора поваренной соли в воде, содержащего 250-270 кг/м3 NaCl, насыщенного хлором. В разла- гатель подается «крепкая амальгама», выходящая из электролизера, и вода.
Электролизер во всех имеющихся конструкциях изготавливается в виде длинного и сравнительно узкого, слегка наклонного стального желоба, по дну которого самотеком течет тонкий слой амальгамы, являющийся катодом, а сверху анолит. Рассол и слабая амальгама подаются с верхнего приподнятого края электролизера через «входной карман».
Крепкая амальгама вытекает с нижнего конца электролизера через «выходной карман». Хлор и хлоранолит совместно выходят через патрубок, также расположенный у нижнего конца электролизера. Над всем зеркалом потока амальгамы или катодом на расстоянии 3-5 мм от катода подвешены аноды. Сверху электролизер перекрыт крышкой.
Распространены два типа разлагателей: горизонтальные и вертикальные. Первые изготавливают в виде стального наклонного желоба той же длины, что и электролизер. По дну разлагателя, устанавливаемого с небольшим наклоном, течет поток амальгамы. В этот поток погружена насадка разлагателя, изготавливаемая из графита. Противотоком движется вода. В результате разложения амальгамы вода насыщается каустиком. Раствор каустика вместе с водородом выходит из разлагателя через патрубок в днище, а бедная амальгама или ртуть насосом перекачивается в карман электролизера.
В комплект электролизной ванны кроме электролизера, разлагателя, карманов и переточных трубопроводов входит ртутный насос. Используются насосы двух типов. В тех случаях, когда ванны оборудованы вертикальным разлагателем или когда разлагатель установлен под электролизером, используются погружные центробежные насосы обычного типа, опущенные в разлагатель. У ванн, у которых разлагатель установлен рядом с электролизером, амальгаму перекачивают конусным роторным насосом оригинального типа.
Все стальные части электролизера, соприкасающиеся с хлором или хлоранолитом, защищают покрытием из вулканизированной резины особой марки (гуммирование). Защитный слой резины не является абсолютно стойким. Со временем он хлорируется, от действия температуры становится хрупким и растрескивается. Периодически защитный слой возобновляют. Все остальные части электролизной ванны: разлагатель, насос, перетоки - делают из незащищенной стали, так как ни водород, ни раствор каустика ее не корродируют.
В настоящее время в ртутном электролизере наиболее распространены графитовые аноды. Однако на замену им приходят ОРТА.
6.Техника безопасности в хлорном производстве
и охрана окружающей среды
Опасность для персонала в производстве хлора определяется высокой токсичностью хлора и ртути, возможностью образования в аппаратуре взрывоопасных газовых смесей хлора и водорода, водорода и воздуха, а также растворов треххлористого азота в жидком хлоре, применением в производстве электролизеров - аппаратов, находящихся под повышенным электрическим потенциалом относительно земли, свойствами едкой щелочи, вырабатываемой в этом производстве.
Вдыхание воздуха, содержащего 0,1 мг/л хлора в течение 30- 60 мин, опасно для жизни. Вдыхание воздуха, содержащего более 0,001 мг/л хлора, раздражает дыхательные пути. Предельно допустимая концентрация (ПДК) хлора в воздухе населенных пунктов: среднесуточная 0,03 мг/м3, максимальная разовая 0,1 мг/м3, в воздухе рабочей зоны производственных помещений составляет 1 мг/м3, порог восприятия запаха 2 мг/м3. При концентрации 3-6 мг/м3 ощущается отчетливый запах, происходит раздражение (покраснение) глаз и слизистых оболочек носа, при 15 мг/м3 - раздражение носоглотки, при 90 мг/м3 - интенсивные приступы кашля. Воздействие 120 - 180 мг/м3 в течение 30-60 минут опасно для жизни, при 300 мг/м3возможен летальный исход, концентрация 2500 мг/м3 приводит к гибели в течение 5 минут, при концентрации 3000 мг/м3 летальный исход наступает после нескольких вдохов. Максимально допустимая концентрация хлора для фильтрующих промышленных и гражданских противогазов составляет 2500 мг/м3.
Наличие хлора в воздухе определяют приборами химической разведки: ВПХР, ППХР, ПХР-МВ с использованием индикаторных трубок ИТ-44 (розовая окраска, порог чувствительности 5 мг/м3), ИТ-45 (оранжевая окраска), аспираторами АМ-5, АМ-0055, АМ-0059, НП-3М с индикаторными трубками на хлор, универсальным газоанализатором УГ-2 с диапазоном измерения 0-80 мг/м3, газосигнализатором «Колион-701» в диапазоне 0-20 мг/м3. На открытом пространстве - приборами СИП «КОРСАР-Х». В закрытом помещении - приборами СИП «ВЕГА-М». Для защиты от хлора при неисправностях или аварийных ситуациях всё находящиеся в цехах люди должны иметь при себе и своевременно применять противогазы марок «В» или «БКФ» (кроме цехов ртутного электролиза), а также защитную спецодежду: суконные или прорезиненные костюмы, резиновые сапоги и рукавицы. Коробки противогазов против хлора должны быть окрашены в желтый цвет.
Ртуть более ядовита, чем хлор. Предельно допустимая концентрация ее паров в воздухе составляет 0,00001 мг/л. Она поражает организм человека при вдыхании и при попадании на кожу, а также при соприкосновении с амальгамированными предметами. Пары и брызги ее адсорбируются (поглощаются) одеждой, кожей, зубами. В то же время ртуть легко испаряется при температуре; имеющейся в цехе электролиза, и концентрация ее паров в воздухе намного превышает предельно допустимую. Поэтому цехи электролиза с жидким катодом оборудуют мощной вентиляцией, которая при нормальной работе обеспечивает в атмосфере цеха допустимый уровень концентрации паров ртути. Однако этого недостаточно для безопасной работы. Еще необходимо соблюдать так называемую ртутную дисциплину: выполнять правила обращения с ртутью. Следуя им, персонал до начала работы проходит через санпропускник, в чистом отделении которого оставляет домашнюю одежду и одевает свежевыстиранное белье, являющееся спецодеждой. В конце смены верхняя спецодежда и грязное белье оставляются в грязном отделении санпропускника, а работающие принимают душ, чистят зубы и в чистом отделении санпропускника одевают домашние вещи.
В цехах, в которых работают с хлором и ртутью, следует пользоваться противогазом марки «Г» (коробка противогаза окрашена в черный и желтый цвета) и резиновыми перчатками., Правила «ртутной дисциплины» предусматривают, что работа с ртутью и амальгамированными поверхностями должна производиться только под слоем воды; пролитая ртуть должна тотчас же смываться в канализацию, где имеются ртутные ловушки.
Для окружающей среды представляют опасность выбросы хлора и паров ртути в атмосферу, сбросы в сточные воды солей ртути и капельной ртути, соединений, содержащих активный хлор, и отравление почвы ртутными шламами. Хлор в атмосферу попадает при авариях, с вентиляционными выбросами и абгазами из различных аппаратов. Пары ртути выносятся с воздухом из вентиляционных систем. Норма содержания хлора в воздухе при выбросе в атмосферу 0,03 мг/м3. Эта концентрация может быть достигнута, если применять щелочную многоступенчатую промывку абгазов. Норма содержания ртути в воздухе при выбросах в атмосферу 0,0003 мг/м3, а в стоках при сливе в водоемы 4 мг/м3.
Нейтрализуют хлор следующими растворами:
известковым молоком, для чего 1 весовую часть гашеной извести заливают 3 частями воды, тщательно перемешивают, затем сверху сливают известковый раствор (например, 10 кг гашеной извести + 30 литров воды);
5%-ным водным раствором кальцинированной соды, для чего 2 весовых части кальцинированной соды растворяют при перемешивании с 18 частями воды (например, 5 кг кальцинированной соды + 95 литров воды);
5%-ным водным раствором едкого натра, для чего 2 весовых части едкого натра растворяют при перемешивании с 18 частями воды (например, 5 кг. едкого натра + 95 литров воды).
При утечке газообразного хлора для погашения паров распыляют воду. Норма расхода воды не нормируется.
При разливе жидкого хлора место разлива ограждают земляным валом, заливают известковым молоком, раствором кальцинированной соды, едкого натра, либо водой. Для обезвреживания 1 тонны жидкого хлора необходимо 0,6-0,9 тонны воды или 0,5-0,8 тонны растворов. Для нейтрализации 1 тонны жидкого хлора необходимо 22-25 тонн растворов или 333-500 тонн воды.
Для распыления воды или растворов применяют поливомоечные и пожарные машины, авторазливочные станции (АЦ, ПМ-130, АРС-14, АРС-15), а также имеющиеся на химически опасных объектах гидранты и спецсистемы.
Заключение
Поскольку объемы хлора, получаемого лабораторными методами ничтожно малы в сравнении с постоянно растущим спросом на данный продукт, проводить по ним сравнительный анализ не имеет смысла.
Из электрохимических методов производства самым легким и удобным является электролиз с жидким (ртутным) катодом, однако этот метод не лишен недостатков. Он наносит существенный вред окружающей среде в результате испарения и утечек металлической ртути и газообразного хлора.
Электролизеры с твёрдым катодом исключают опасность загрязнения окружающей среды ртутью. Выбирая между диафрагменными и мембранными электролизерами для новых производственных мощностей, предпочтительнее использовать последние, поскольку они более экономичны, и дают возможность получить конечный продукт более высокого качества.
Список используемой литературы
1.Зарецкий С. А., Сучков В. Н., Животинский П. Б. Электрохимическая технология неорганических веществ и химические источники тока: Учебник для учащихся техникумов. М..: Высш. Школа, 1980. 423 с.
2.Мазанко А. Ф., Камарьян Г. М., Ромашин О. П. Промышленный мембранный электролиз. М.: изд-во «Химия», 1989. 240 с.
.Позин М. Е. Технология минеральных солей (удобрений, пестицидов, промышленных солей, окислов и кислот), ч.1, изд. 4-е, испр. Л., Изд-во «Химия», 1974. 792 с.
.Фиошин М. Я., Павлов В. Н. Электролиз в неорганической химии. М.: изд-во «Наука», 1976. 106 с.
.Якименко Л. М. Производство хлора, каустической соды и неорганических хлорпродуктов. М.: изд-во «Химия», 1974. 600 с.
Итнернет-источники
6.Правила безопасности при производстве, хранении, транспортировке и применении хлора // URL: #"justify">7.Аварийно химически опасные вещества // URL: #"justify">.Хлор: применение // URL: #"justify">.
Об огурцах мы знаем много чего. Часто употребляем их в пищу, добавляем в салаты, консервируем и маринуем, делаем освежающие маски на лицо и под глаза. Этот зеленый овощ — универсальный. Он пригоден не только для поедания, а и для лечебных процедур, благодаря своему составу.
Состав огурца: витамины, микроэлементы, калорийность
Калорийность огурца — не больше 15 ккал на 100 г. Объяснить это можно тем, что на 95% он состоит из воды. Для тех, кто сидит на диете, этот овощ просто незаменимый. В нем практически нет углеводов, жира и белков.
В составе огурца есть ферменты. Они облегчают переваривание пищи животного происхождения, потому часто огурец совмещают с мясными блюдами.
Из микроэлементов в этом овоще больше всего калия . Чуть меньше содержится фосфора, кальция, магния и железа.
Не лишен огурец и витаминов. Он насыщен витаминами С, А, В1 и В2, Р.
Польза огурца
Польза огурца прямо пропорционально связана с его составом. Витамины и минеральные компоненты благосклонно сказываются на функционировании многих органов и систем: печени, сердца и сосудов, почек, желудочно-кишечного тракта и мн. др.
Свежие огурцы
В свежих огурцах высокое содержание клетчатки . Она помогает улучшить моторику кишечника и ускорить переваривание пищи. Так токсины в организме не задерживаются, что немаловажно при постоянных или частых запорах.
Клетчатка противостоит накоплению на стенках сосудов холестерина и образованию бляшек. А это помогает избежать атеросклероза и ишемического заболевания сердца.
Благодаря калию, выведется лишняя жидкость из организма, а значит, отеки спадут. Положительно этот микроэлемент сказывается и на повышенном артериальном давлении.
Наличие йода поможет предотвратить возникновение патологий щитовидной железы.

Соленые, маринованные, квашенные
Соленые огурцы имеют полезные для микрофлоры кишечника бактерии. Они блокируют развитие вредоносных микробов. Наличие в этом блюде молочной кислоты уменьшает количество жиров в крови, что облегчает ее циркуляцию в сосудах. Это помогает снизить высокое давление при гипертонии.
Рассол из огурцов не только улучшает флору кишечника, а и оказывает легкое слабительное воздействие.
Маринованные огурцы помогут разбудить ваш аппетит, потому полезно употреблять их тем, кто желает поправится. Они налаживают работу пищеварительной системы.
Квашенные огурцы обладают теми же свойствами, что и маринованные, и соленые. Но, кроме этого, они усиливают защитную функцию иммунитета.

Сок
Огуречный сок по составу напоминает воду из экологически чистых родников, потому он настолько популярен.
С его помощью происходит регуляция кислотно-щелочного баланса в организме. Выводится лишний натрий и жидкость.
Обратите внимание! Если сок огурца смешать с морковным, то эта смесь является отличным средством при ревматических заболеваниях.
Сок салата, шпината, моркови и огурца в соединении ускорят рост волос и их силу.
Употребление ценного сока из огурца не только понижает артериальное давление, а и помогает в профилактике раковых заболеваний.
Если есть проблемы с зубами или деснами, то помощь окажут полоскания огуречным соком.
Соком также лечат сухой кашель. Для этого к соку добавляют немного меда и принимают внутренне.
В огуречном соке содержится много йода, который легко усваивается. Сок огурца помогает при проблемах со щитовидной железой.

Салат из огурцов
Огурец частый гость на столе, особенно в сезон созревания. Мы его не просто едим, а добавляем в самые разные салаты. От такого нежного по вкусу и невероятно ароматного овоща любое блюдо только выиграет.
Добавляя в салаты огурцы, вы способствуете лучшему усвоению полезных веществ не только из этого овоща, а из других компонентов в блюде.
Если огуречный салат употреблять вместе с мясом или другой калорийной пищей, то она переварится намного быстрее и легче.

Чем полезны огурцы?
Огурцы употреблять полезно практически всем без ограничения. Но есть особенности, которые важны для каждого пола, возраста или периода.
Для организма женщины
Огурцы для женщины — это способ похудеть и выглядеть всегда молодо и свежо.
Этот овощ используется во время диеты, чтобы избавить организм от лишней воды и вместе с ней вывести жировые отложения.
Маски, лосьоны и другие средства по уходу за кожей не оставят равнодушной ни одну женщину. Для того, чтобы всегда выглядеть идеально не нужно бежать в магазин за дорогой косметикой, ведь в вашем холодильнике есть парочка свежих огурчиков.
Регулярные маски, протирания, компрессы из огурцов помогут сделать кожу упругой, молодой и дышащей.
Для организма мужчины
Полезное влияние огурцов на мужской организм схоже с влиянием овоща на женский организм.
Еще одним плюсом в употреблении свежих огурцов является то, что регулярный прием сока из огурца помогает избежать облысения.

Для детей
Для детей огурец важен, поскольку регулярное его употребление позволяет избежать развития анемии из-за дефицита кремния.
В нем содержится калий, а он просто необходим для крепкой нервной системы и уравновешенной психики крохи.
Обратите внимание! Огурец регулирует обменные процессы в кишечнике, делает иммунитет более стойким и укрепляет мышечную и костную ткани ребенка.
Наличие йода защищает щитовидную железу и предотвращает все вытекающие последствия при нехватке этого элемента.
Первый раз дать ребенку попробовать огурец педиатры рекомендуют не раньше года, поскольку желудок еще не способен справится с перевариванием овоща.

Для беременных
Для беременной женщины невероятно важно, чтобы водно-солевой баланс был в норме. В этом ей поможет огурец, в составе которого есть калий. Он помогает выводить лишнюю воду из тканей и не накапливаться ей снова в чрезмерном количестве.
Во время беременности возникают проблемы с опорожнением кишечника. Вследствие этого женщину беспокоят запоры. Наладить естественный процесс можно с помощью свежего огурца, поскольку он действует, как легкое слабительное .
Также огурец очищает организм от вредных веществ, что важно в период беременности.

Для лица
Польза огурца явна не только при потреблении во внутрь, но и при наружном использовании. Благодаря способности запускать процесс регенерации кожных клеток, этот овощ включают в состав самых разных косметических средств по уходу за кожей тела от головы до пят.
В домашних условиях очень просто провести косметическую процедуру по омоложению лица. Достаточно будет того, что вы протрете лицо кружочком огурчика или наложите их на проблемные зоны.
С помощью таких простых масок вы сможете отбелить кожу, сделать менее заметной пигментацию и веснушки.
Огурец прекрасно подходит для эпидермиса жирного типа в качестве очищающего средства. Сухую кожу он увлажнит и омолодит.
Также огуречные примочки помогут избавиться от отеков, синих кругов под глазами и ощущения усталости.
Противопоказания и вред огурца для здоровья
Из-за сильного мочегонного воздействия свежие огурцы нельзя есть людям с камнями в почках, язвой желудка и энтероколитами.
Это близкий родственник кабачка, арбуза и дыни, относится к семейству тыквенных . Его научное название «cucumis sativus » переводится с латыни как «огурец посевной ». Согласно информации из ботанических справочников, плод этого растения причисляют к ягодам. Правда, с оговоркой – к ложным ягодам. По кулинарным и вкусовым характеристикам огурец всё же считается овощной культурой, которая, к слову, занимает 4 место в мире по объёмам выращивания среди овощей .
История
Огурец считается одним из древнейших представителей овощных культур, появившимся четыре тысячелетия назад. Хотя существуют смелые предположения о том, что огурцу уже более 6 тысяч лет. Нет однозначной информации и по поводу родины этого овоща, но, вероятнее всего, это были тропические и субтропические районы Древней Индии и Китая. Однозначно можно сказать, что изначально огурец произрастал в диком виде. Лишь во втором тысячелетии до н.э. древние индийцы его окультурили и постепенно ввели в свой рацион .
Благодаря увеличению объёмов выращивания и налаженным торговым связям, из Индии и Китая огурец отправился покорять мир. Именно так он попал в Египет, Древнюю Грецию, а много позже и в Римскую Империю. Есть основания полагать, что именно от греческого названия этого зелёного овоща «ἄγουρος» (восходит к «ἄωρος» – незрелый) и произошло слово «огурец». Кстати, английское название «cucumber» произошло от французского слова «concombre», которое, в свою очередь, было заимствовано из латинского языка («cucumis») .
О том, что в древние времена огурец был важной частью рациона людей, свидетельствуют его изображения на фресках в греческих и египетских храмах. Кроме того, полезные свойства этого хрустящего овоща были описаны Аристотелем и Гиппократом. В Древнем Риме огурцы употребляли в пищу как элитные сословия, так и низшие классы. А император Тиберий приказал подавать ему по одному огурцу каждый день в году. Тогда огурцы стали выращивать в ящиках на колёсах для того, чтобы можно было перемещать их вслед за солнечным светом. Считается, что в то же время появились первые рецепты засолки.
Из Римской Империи огурец распространился по всей территории Европы (во Франции – с IX в., в Англии – с XIV в.). В XV столетии, благодаря Колумбу, огурец достиг берегов Нового Света, где также очень быстро завоевал популярность среди местных жителей. Однако в начале XVII в. в Америке появилась информация о том, что употреблять в пищу сырые овощи и фрукты опасно для здоровья, поэтому огурец на какое-то время утратил свои позиции и получил издевательское прозвище «cowcumber» (англ. огурец для кормления коров). Лишь около сотни лет спустя зелёный овощ вернулся на столы американцев .
Доподлинно неизвестно, когда и как огурец попал на Русь. Существует теория, что к нам этот овощ приехал из Европы уже после крещения Руси. Хотя некоторые учёные полагают, что наши купцы покупали огурцы в Восточной Азии ещё в ІХ в. В любом случае, одно из первых письменных упоминаний об этом овоще датируется первой половиной ХVIІ в. (записки немецкого путешественника Эльшлегера). В это же время Петр I издал указ о выращивании этой культуры в царском саду. Именно тогда стали появляться первые теплицы.
Сорта
Несмотря на то, что для нормального созревания огурцам необходим набор определённых условий, благодаря усилиям селекционеров, сейчас они культивируются в разных климатических зонах и на разных по своему составу почвах. Главное – правильно подобрать сорт.
В зависимости от сроков созревания, огурцы делят на раннеспелые, созревающие до 45 дней (амур, артист, Гектор, Маша), среднеспелые, созревающие до 50 дней (конкурент, неженский, застольный, тёща), и позднеспелые, созревающие более 50 дней (феникс, водолей, Алиса). Также существует разделение сортов огурцов по предназначению: для употребления в свежем виде, для засолки или консервации и универсальные, подходящие для обеих целей.
Интересно, что у известного нам продолговатого зелёного овоща есть много экзотических родственников, которые считаются его разновидностями. Например, африканский огурец Кивано имеет жёлтую кожуру с шипами и сочную зелёную мякоть, немного напоминающую наш традиционный огурец. Яйцо дракона отличается гладкостью и светлым цветом оболочки, округлой формой и сладковатым вкусом. А огурцы сорта Красный хмонг при созревании становятся красными, а вкусом немного напоминают дыню.
Огурец под названием Гак или Весенний горький обладает оранжево-красной кожурой и мягкой красной мякотью. В нём содержится большое количество антиоксидантов, что делает его очень полезным, однако, он плохо переносит транспортировку, поэтому его можно найти лишь в местах выращивания . Существуют также декоративные дикие огурцы, которые в народе ещё называют ежовыми. Ними оплетают изгороди и заборы, а их плоды покрыты иголочками. Особенность этих огурцов состоит в том, что в момент созревания кожура на плоде максимально натягивается и лопается. При этом из двух небольших отверстий под давлением вылетают семечки и немного слизи.

Особенности выращивания
Огурец – это лианоподобное растение со стелющимся стеблем, который может достигать двух и более метров в длину. От главного стебля отходят боковые побеги и усики, с помощью которых растение может закрепляться на опорах, принимая вертикальное положение. Благодаря этому выращивать огурцы можно на шпалерах (обычно этот метод используют в теплицах и на балконах), хотя, если место на огороде/грядке позволяет, то стеблю дают стелиться по земле. Длина и степень ветвистости зависит от сорта .
Во время цветения на растении образовываются мужские (с тычинками) и женские (с пестиками) цветки жёлтого цвета. Женские цветки отличаются тем, что под ними есть завязь и они располагаются одиночно или по 2-3 штуки на боковых побегах, в то время как мужские цветки (пустоцветы) образуют соцветия из 5-7 штук преимущественно на основном стебле. Оплодотворение происходит в основном во время раскрытия цветков (1-2 дня). Пыльца переносится благодаря пчёлам и другим насекомым, которых привлекает яркий жёлтый цвет и наличие нектара.
В случае холодной погоды или в условиях тепличного выращивания процесс опыления усложняется – делается вручную, поэтому селекционеры стали выводить гибриды. Они получаются благодаря искусственному опылению цветков разных сортов. В своём названии гибрид обязательно имеет отличительный символ – F (filli – итал. дети) и цифру, которая обозначает номер поколения. Более того, в наше время появились огурцы вовсе не требующие опыления – партенокарпические, а также самоопыляемые – в их цветках есть одновременно и тычинка, и пестик .
Урожай огурцов обычно начинают собирать, когда плоды ещё биологически не созрели, поэтому их называют зеленцами. Дозреть и приобрести жёлто-коричневый оттенок дают только тем огурцам, из которых берут семенной материал для посадки или для селекции.
Посадка огурцов может осуществляться как рассадой, так и семенами. Обычно рассада обеспечивает более ранний урожай, но и требует большего внимания. После высадки на грядки молодые растения нужно укутывать в случае понижения температуры. В целом, огурец – теплолюбивое, влаголюбивое и светолюбивое растение, не переносящее сквозняков (на заметку тем, кто растит овощи дома на подоконниках). Сажать огурцы рекомендуется на расстоянии не менее 20 см друг от друга на глубину 2-2,5 см. во вторую или третью декаду мая (при температуре от 18 до 25 °С).
Среди главных огуречных вредителей выделяется паутинный клещик, который селится на нижней стороне листьев и питается их соком, что приводит к появлению белых точек на листьях, а затем, оплетённые паутиной, они засыхают. Также огурцы боятся бахчевой тли, которая живёт на всех частях растения и высасывает его соки. После этого листья начинают желтеть и отмирать. Опасен также и огуречный комарик, чья полупрозрачная личинка с чёрной головкой внедряется в стебель и корень ослабленного растения, после чего оно погибает.
Для борьбы с вредителями обычно используются химикаты. Однако для того чтобы предотвратить попадание вредоносных насекомых на растение, нужно делать регулярную прополку, удаляя сорняки.

Как выбрать
В летнее время года огурцы лучше покупать утром, пока они не успели утратить свою свежесть, лёжа на солнце. Если огурцы уже немного увяли, то можно их «оживить», оставив в прохладной воде на 2-3 часа. К слову, замачивание в холодной воде (около 30 минут) способствует выведению нитратов. Для пущего эффекта следует положить огурцы в прозрачную посуду и оставить в светлом месте (солнечные лучи способствуют ускорению выведения вредных веществ).
Покупаемые огурцы должны быть плотными, без видимых повреждений и жёлтых пятен. Покупая огурцы вне сезона, следует обращать внимание на неестественный блеск. Импортные овощи часто при транспортировке покрывают тонким слоем парафина для их лучшей сохранности. В этом случае перед употреблением овоща необходимо срезать кожуру. А если внутри и вовсе не окажется семян, то такой огурец лучше выбросить, из-за наличия в нем большого количества опасных веществ.
В целом, выбор огурцов зависит от вашей цели. Для салата можно использовать практически все огурцы, но наиболее подходящими считаются специально выведенные гладкие плоды с толстой шкуркой, длиной около 13 см. Они обладают насыщенным ароматом. Можно брать огурцы с белыми шипами.
Лучшие маринованные огурцы получаются из плодов 9-12 см в длину с тёмными шипами (они легко снимаются при мытье, что позволяет рассолу интенсивно пропитывать огурец). Для засолки рекомендуют брать огурцы размером до 9 см. (короткоплодые корнишоны) тёмно-зеленого цвета со светлыми кончиками или светлыми полосками на боку. Также подойдут плоды с тёмными шипами.
Как хранить
Что касается хранения свежих огурцов, то обычно они могут лежать в холодильнике около 3-5 дней. Важно обеспечить им поступление воздуха и не хранить их рядом со спелыми фруктами и овощами. Чтобы увеличить срок хранения до 10 дней, их кладут в целлофановый пакет, сверху накрывают мокрой марлей и отправляют в холодильник. Около двух недель в холодильнике могут храниться огурцы, завёрнутые в бумажные полотенца и уложенные в незакрытый пакет . Для того чтобы овощи оставались свежими в течение 3-4 недель, их опускают хвостиками в прохладную воду на 1-2 см. и ставят в холодильник. Воду в ёмкости необходимо менять каждые сутки.
Полезные свойства огурцов
Химический состав и наличие полезных веществ
| Основные вещества (мг/100 г): | Свежий с кожурой | Свежий без кожуры | Маринованные |
| Вода | 95,23 | 96,73 | 94,08 |
| Белки | 0,65 | 0,59 | 0,33 |
| Жиры | 0,11 | 0,16 | 0,20 |
| Углеводы | 3,63 | 2,16 | 2,26 |
| Сахар | 1,67 | 1,38 | 1,06 |
| Пищевые волокна | 0,5 | 0,7 | 1,2 |
| Калории (Ккал) | 15 | 10 | 11 |
| Минералы | |||
| Калий | 147 | 136 | 23 |
| Фосфор | 24 | 21 | 14 |
| Кальций | 16 | 14 | - |
| Магний | 13 | 12 | 4 |
| Натрий | 2 | 2 | 1208 |
| Железо | 0,28 | 0,22 | 0,40 |
| Цинк | 0,20 | 0,17 | 0,02 |
| Витамины | |||
| Витамин C | 2,8 | 3,2 | 1 |
| Витамин РР | 0,098 | 0,037 | - |
| Витамин В6 | 0,040 | 0,051 | 0,009 |
| Витамин В2 | 0,033 | 0,025 | 0,010 |
| Витамин Е | 0,030 | 0,03 | 0,09 |
| Витамин В1 | 0,027 | 0,031 | - |
| Витамин К | 0,016 | 0,007 | 0,047 |
| Витамин В9 | 0,007 | 0,014 | 0,001 |
| Витамин А | 0,005 | 0,004 | 0,01 |
Опираясь на вышеприведённые таблицы, можно сделать вывод, что полезнее всего употреблять в пищу огурцы вместе с кожурой, в которой содержится немало полезных веществ. Однако и без кожуры, и маринованные , огурцы сохраняют некоторые полезные свойства. Правда, стоит учитывать, что в засоленном или маринованном виде в них резко подскакивает уровень натрия, что может негативно сказаться на здоровье людей, страдающих почечной недостаточностью . Вместе с тем, уменьшается доля витаминов, снижается уровень содержания калия, магния, цинка и кальция. А слишком большое количество соли может приводить к разрушению зубной эмали, задержке жидкости в организме и нарушении работы ЖКТ.

Лечебные свойства
Огурец уступает многим овощам в содержании витаминов, поскольку практически полностью состоит из воды . Однако огуречная вода богата минеральными солями и биологически активными веществами. Например, в огуречных плодах есть ферменты , способствующие усвоению белков и витаминов группы В, а также поддержанию нормальной реакции крови. Более того, огурцы содержат фермент, похожий на инсулин, что делает его важным продуктом рациона диабетиков .
Кроме того, огуречная вода помогает очистить организм, растворяя токсины. То есть огурец не должен использоваться в качестве самостоятельной еды, но он играет значительную роль в усвоении другой пищи, например мяса. Благодаря своей низкой калорийности огурцы рекомендуются людям, склонным к ожирению .
Хоть и в небольшом количестве, но огурцы содержат фосфор, калий, кальций, серу, магний, натрий, железо, цинк и йод (в легкоусвояемой форме). За счёт этого они обладают желчегонными и мочегонными свойствами, помогают улучшить деятельность сердечно-сосудистой системы, рекомендованы людям, страдающим болезнями щитовидной железы . Кроме того, такой набор микроэлементов способствует улучшению состояния ногтей, волос, зубов человека и снижает кислотность желудочного сока. К слову, клетчатка , входящая в состав огурцов, наилучшим образом сказывается на процессе пищеварения. А лёгкий слабительный эффект помогает избавиться от запоров .
Что касается витаминов, то огурцы могут похвастаться наличием в своём составе каротина, тиамина, рибофлавина, фолатов и т.д. Последние принимают активное участие в регулировании уровня гомоцистеина – аминокислоты , которая образуется в организме во время метаболизма, и увеличивает риск атеросклеротического поражения сосудов и тромбообразования.
Ещё одной полезной составляющей огурца считается фитостерол (фитостерин) – стероидный спирт, который не растворяется в воде. По сути, речь идёт о растительном двойнике холестерина. Его преимущество состоит в том, что он безопасен для человека и не провоцирует развитие атеросклероза . Попадая в организм, фитостерол ингибирует до 10% всасывания холестерина и вместо него проникает в кровь, не нанося никакого вреда организму.
Использование в медицине
В традиционной медицине огурец, несмотря на наличие полезных элементов и свойств, не используется и фармакопейным растением не считается. Тем не менее, зелёные плоды уже долгое время активно и успешно применяется в народной медицине и косметологии.
Во-первых, самое простое народное применение огурца – наружное. При получении небольших ожогов , ссадин или ран рекомендуют приложить к повреждённому месту разрезанный огурец или смазать это место свежим огуречным соком. Это гарантирует мощный противомикробный эффект (даже в случае нагноения). Во-вторых, на основе огурца готовят различные отвары, настои, из них делают компрессы. Более того, в оборот идут не только сами плоды и сок, но также цветки, листья и плети растения (как правило, в высушенном виде).

Отвары и настои
Отвар из свежих огурцов может помочь избавиться от отёков , появившихся вследствие сердечных патологий или варикоза . Для этого нужно мелко нарезать 100 г помытого огурца, залить его 200 мл кипятка и варить на маленьком огне 5 минут. Полстакана такого отвара нужно пить до еды три раза в день на протяжении 7-10 дней.
Напитки
Огуречный сок обладает массой полезных свойств, поэтому его рекомендуют пить в чистом виде. Однако благодаря освежающему эффекту, который оказывает огурец, его часто добавляют в различные летние напитки. Например, коктейль из лайма и арбуза (200 г мякоти арбуза, 1/2 лайма, 1\2 огурца, пучок мяты и вода) или смузи из шпината и сельдерея (смолоть в блендере: 100 г шпината , 1 зелёное яблоко, 1 огурец, 1 стебель сельдерея, 1 кусочек имбиря , 2 ст.л. лимонного сока). Также пользуется популярностью огуречная вода (1 огурец, 1 пучок мяты, половина лимона, 1 л воды).
Использование в косметологии
Огурец считается хорошим косметическим средством, которое оказывает освежающее и омолаживающее действие на кожу. Благодаря фитостеролу, происходит удержание влаги и имеется небольшой лифтинг-эффект. А щелочные соли обеспечивают питание кожи и оказывают отбеливающее действие, снимая зубной налёт.

Сейчас существует огромный выбор всевозможных масок, лосьонов, тоников, гелей на основе огурца, но летом приготовить косметическое средство можно и в домашних условиях.
Для того чтобы освежить кожу лица после переутомления, недосыпания или стресса необходимо взять 1 огурец и 1 куриный белок. Следует натереть огурец на мелкой тёрке и взять 2 ст.л. кашицы, соединив их со взбитым до пены яичным белком. Затем маску нанести на лицо на 15 минут и смыть водой. А для кожи вокруг глаз рекомендуется смешать 2 ст.л. тёртого огурца с измельчённой петрушкой .
Для достижения омолаживающего эффекта необходимо смешать 1 ст.л. тёртого огурца с 1 ч.л. белой глины. Увлажняющее действие дарит маска, приготовленная из 1 ст.л. тёртого огурца, 1 ч.л. измельчённой мяты и 1 ч.л. измельчённого базилика .
Одной из первых стран, где огурец окультурили и стали употреблять в пищу, был Китай. Существует легенда, согласно которой именно китайцы познакомили с этим овощем Турцию. Помимо прочих презентов, они послали турецкому Султану Магомеду II в подарок несколько экзотических плодов – огурцов. Султану диковинный овощ пришёлся по вкусу, и он призвал семерых лучших придворных стражников охранять его. Тем не менее, один огурец исчез, и при этом все стражники отрицали свою причастность к краже. Тогда разъярённый султан решил устроить своеобразный обыск, отдав приказ вспороть животы всем семерым.
Возможно, именно поэтому в турецком языке появилась поговорка «За огурцом с топором присматривать». Правда, сейчас такие слова обычно адресуют человеку, совершающему глупость. В английском и русском языках пословицы про огурцы имеют скорее положительное значение. Так, англичане говорят «as cool as a cucumber », что дословно переводится, как «спокоен, как огурец » и означает абсолютную невозмутимость. В России можно часто услышать выражение «быть как огурчик », что значит быть бодрым и хорошо выглядеть. А бразильцы и вовсе используют слово «chuchuzinho » (порт. чайот или мексиканский огурец) для ласкового обращения к любимым людям.
Кстати, о любви. В 2011 году в России был снят сериал под названием «Огуречная любовь», который повествует о жизни в маленькой деревушке Горелково, известной своими огуречными полями. Кроме того, ещё в 1985 году в Советском Союзе по сказке Галины Лебедевой был создан мультфильм «Огуречная лошадка». Сюжетообразующую роль зелёные хрустящие овощи играют и в поучительном рассказе «Огурцы» детского писателя-прозаика Николая Носова. Также обращались к теме огурцов писатели Владимир Клименко (рассказ «Бешеные огурцы») и Всеволод Иванов (рассказ «Нежинские огурцы»).

Не обошли своим вниманием этот зелёный овощ и великие живописцы. Знаменитыми стали натюрморты «Огурцы» Кондрата Максимова и Михаила Махалова (1), а также картина «Натюрморт с овощами» Ивана Хруцкого. Более того огурцы начали изображать на своих полотнах ещё художники Средневековья. Так, испанец Луис Менделес написал натюрморт «Огурцы, помидоры и посуда». А итальянец Джузеппе Арчимбольдо использовал огурец для изображения носа персонажа на картине «Лето» (2).
А Карло Кривелли отличился тем, что вписывал огурцы в христианские сюжеты своих картин. До сих пор учёные не сходятся во мнениях по поводу символики огурцов на серии полотен Кривелли «Мадонна с младенцем» (3) и «Благовещение». Поскольку на них огурец часто расположен рядом с яблоком, его иногда по аналогии интерпретируют, как символ искушения и первородного греха. Хотя некоторые исследователи полагают, что огурец, напротив, символизировал Воскресение и жизненную силу.
Видимо, в жизненную силу, которую дарит огурец, верят и современные жители острова Фиджи. Они не только поглощают огурцы, но и готовят их запасы на случай неурожая или природного катаклизма. Как правило, овощи обматывают банановыми листьями и закапывают в землю. Кроме того, размеры запасов огурцов могут помочь мужчине жениться, поскольку родители девушек обычно охотнее отдают замуж своих дочерей за «огуречных магнатов».
К слову, на Фиджи, а также в Азии, популярны не только огурцы в том виде, в каком мы привыкли их видеть, но и так называемые морские огурцы. На самом деле речь идёт о голотуриях – беспозвоночных животных типа иглокожих. Употребляемые в пищу виды обычно обобщённо называют «трепанги ». Эти восточные морепродукты считаются чрезвычайно полезными деликатесами, поэтому их часто отлавливают незаконно и продают на чёрном рынке . Там цена за 1 кг морских огурцов может доходить до 500$.
Свои рекорды, правда, вполне законно, бьют и наши традиционные зелёные овощи. В Великобритании двое пенсионеров независимо друг от друга вырастили на своих грядках плоды длиной 1,2 м . Однако самым длинным огурцом считается овощ, созревший в одной из теплиц Венгрии. Рекордные 1,83 м занесены в книгу рекордов Гиннеса.
В разных уголках мира люди увековечивали огурец, воздвигая ему памятники. Например, такой монумент есть в польском Познани. Также в украинском Нежине существует памятник неженскому огурцу, а в белорусском Шклове – бронзовый огурец «Наполеон». Почитают этот овощ в Австрии – в Зальцбурге существует целая инсталляция «Огурцы». С уважением относятся и в России, ведь помимо памятника, в подмосковных Луховицах есть целый музей, посвящённый огурцу.
А вот в Лондоне огурец почтили с размахом. Памятника здесь нет, зато в 2004 году появилось высотное здание 30 St Mary Axe (Сент-Мэри Экс 30), которое сами англичане из-за внешнего сходства и зеленоватой подсветки называют «The Gherkin» (англ. огурец). Интересно, что на самом деле на создание этого архитектурного проекта создателей вдохновила шишка.

Опасные свойства огурцов и противопоказания
Огурцы – диетический продукт, но даже они иногда могут нанести вред организму. Отказаться от их употребления рекомендуют в таких случаях:
- обострение язвы желудка;
- острые и хронические гастриты и энтероколиты;
- острые и хронические нефриты и пиелонефрит, а также гепатит и холецистит (нужно избегать употребления солёных огурцов);
- кормление младенца (может вызвать расстройство желудка и колики у малыша).
Ошибочное мнение о том, что огурцы не приносят пользы для человека из-за большого содержания воды, давно стоит пересмотреть. Этот овощ является уникальным продуктом, который необходимо включить в рацион каждому. Польза огурцов для человека неоспорима, и познакомиться с культурой поближе будет очень интересно. Узнать стоит и о том, какой вред для здоровья могут нанести огурцы.
Калорийность огурца мала и составляет всего 14 ккал на 100 г продукта. На 95% овощ состоит из уникальной структурированной воды, которая способна очищать организм от солей тяжелых металлов и большинства токсинов. Энергетическая ценность огурца в приготовленном виде меняется:
- калорийность соленых огурцов только 11 ккал;
- калорийность маринованных огурцов немного выше, чем у сырых и достигает 16 ккал на 100 г.
Пищевая ценность этого овоща высокая за счет содержания в них разнообразных витаминов и минералов. Химический состав огурцов представлен ниже в таблице.
Польза огурцов для здоровья человека связана и с присутствующими в них грубыми, не растворимыми волокнами клетчатки. Они восстанавливают правильную работу кишечника и очищают его от скоплений шлаков и каловых камней, которые представляют серьезную угрозу.
Имеющиеся в составе растения фитостеролы способствуют связыванию и выведению из организма лишнего холестерина. Фолаты, которые также присутствуют в овоще, поддерживают сосудистую систему.
Учитывая богатство состава огурцов, при отсутствии противопоказаний к их применению, стоит включить овощ в свое ежедневное меню. Калорийность свежего огурца настолько низка, что не стоит волноваться из-за того, что этот овощ повредит фигуре.

Полезные свойства для организма
Польза огурцов для организма человека не вызывает сомнения, но только в том случае, если употребление овоща будет правильным. Важно есть его в сочетании с прочими продуктами. Также надо знать меру в количестве потребляемых огурцов, чтобы не вызвать расстройство пищеварения. Максимальная суточная норма продукта, которую можно съесть с пользой для организма – 500 г.Особенно полезно есть огурцы в натертом или мелконарезанном виде. В такой форме полезные вещества в процессе пищеварения высвобождаются из огурцов активнее и всасываются в кишечнике быстрее.
Детей
Для детей употребление огурцов является обязательным. Этот овощ, из-за высокого содержания чистейшей воды, крайне редко вызывает аллергию и при этом восполняет потребность организма в большинстве витаминов и минералов. Впервые огурцы начинают вводить в меню ребенка с возраста в 12 месяцев. Сразу давать продукт в большом количестве, даже если он очень нравится ребенку, не следует из-за послабляющего действия огурца на кишечник.
Вначале огурцы вводят по 1 чайной ложке в сутки. Если они положительно принимаются организмом малыша, то дозировку увеличивают вдвое. Постепенно порцию огурцов доводят до 5-8 столовых ложек в день.
Полезные свойства огурца для организма ребенка заключается в следующем:
- предупреждение появления анемии – такое свойство овоща связано с его способностью устранять дефицит кремния в организме ребенка. При недостатке минерала происходят нарушения в составе крови и падение уровня красных кровяных телец, из-за чего развивается достаточно стойкая анемия, устранить которую сложно без применения медикаментозных средств;
- предупреждение появления эндокринных заболеваний на фоне нарушения в работе щитовидной железы – происходит благодаря высокой концентрация йода. Даже при значительном дефиците вещества в организме при регулярном употреблении огурцов йододефицит у ребенка устраняется;
- поддержание здоровья и нормализация работы нервной системы – калий, который содержится в составе огурцов, благотворно воздействует на ЦНС и помогает детям легче переносить стрессы, связанные с началом посещения детского сада или переходом к школьной жизни. Также калий повышает выносливость организма и его способность легче переживать значительные нагрузки;
- улучшение работы головного мозга – это свойство огурцов связано с наличием в их составе чистой воды, которая очищает организм от токсинов и солей тяжелых металлов. Детские системы и органы быстро реагируют на избавление от вредных веществ, в том числе и головной мозг. Когда дети подвергаются серьезным интеллектуальным нагрузкам, огурцы способствуют облегчению усвоения нового материала и предупреждению появления мозгового переутомления, которое опасно возникновением в дальнейшем полного отсутствия интереса к обучению;
- поддержание качественного обмена веществ – сегодня, из-за присутствия в продуктах питания большого количества химических добавок, нарушения обмена веществ все чаще отмечаются у детей. Если ребенок ежедневно будет употреблять огурцы, то такая проблема для него не возникнет. Связано это с тем, что, нормализуя процесс пищеварения, овощ еще и выводит из организма вредные вещества, а также регулирует процесс всасывания в кишечнике, предупреждая его сбои;
- повышение иммунитета – укрепляющее иммунитет свойство огурцов подтверждено медицинскими исследованиями. Овощ помогает организму детей качественнее противостоять заболеваниям и очищает лимфоидные ткани (в первую очередь гланды и аденоиды), от чего их правильная работа восстанавливается, и вирусы блокируются на первом этапе проникновения в организм. Если ребенок болеет очень часто, то ему рекомендуется давать ежедневно вечером салат из тертого огурца с чесноком и оливковым маслом. Такое средство является сильнейшим иммуномодулятором.

В том случае если есть опасения относительно того, когда ребенку из-за особенностей его развития или наличия врожденных хронических заболеваний можно давать продукт, следует проконсультироваться с врачом относительно введения в рацион огурцов.
Чем полезен огурец для женщин
Для женского организма огурец также очень полезен и не только своей низкой калорийностью, а и прочими положительными воздействиями на орагнизм.
- Снижение веса. Достигается этот эффект, если употреблять огурцы ежедневно. Связано это с тем, что вещества из состава овоща помогают предотвратить переход углеводов в организме в жиры и тем самым мешают образованию жировых клеток. В некоторой степени продукт также расщепляет и уже имеющиеся отложения, но не так эффективно, чтобы сбросить вес только при помощи включения огурцов в рацион.
- Ускорение переваривания пищи. Благодаря огурцам, даже жирная и тяжелая еда усваивается значительно быстрее, от чего снижается нагрузка на печень и кишечник; а также не успевают образовываться шлаки, которые возникают, если начинается процесс брожения в кишечнике. Из-за этого не только устраняется вздутие живота, а еще улучшается состояние кожи, волос и ногтей. Также это свойство овоща стимулирует восстановление менструального цикла, сбои которого часто связаны с переизбытком шлаков, отравляющих организм.
- Общее тонизирование организма. Таким свойством обладает огуречный сок. Его достаточно пить по утрам для того, чтобы снять хроническую усталость и восстановить упругость кожи, потеря которой слишком рано приводит к возникновению мимических морщин и гусиных лапок. Также сок активно запускает процесс пищеварения, от чего даже после спешного и неправильного завтрака отсутствует чувство тяжести. Полностью снимается таким напитком и проблема запоров, которая у женщин становится причиной сероватого цвета кожи и преждевременного старения.
- Предотвращение болезней вен. Компоненты из состава огурцов помогают в укреплении сосудистых стенок и восстановлении правильности работы венозных клапанов. Из-за этого снижается риск появления варикозного расширения вен и гипертонической болезни, а также и вероятность получения инсульта, даже в глубоком возрасте.
Употреблять огурцы особенно активно надо в сезон, когда они хранятся минимум времени и не успевают растерять своих полезных свойств.
Используют женщины культуру и как средство для ухода за кожей для масок и лосьонов для лица. Они замедляют процесс старения и устраняют морщинки. Огуречную маску можно делать ежедневно.
Мужчин
Так как кардинальных различий в большинстве процессов в организмах мужчин и женщин нет, то действие огурцов на представителей сильного пола не очень отличается от оказываемого на женщин. Дополнительно они стимулируют в мужском организме выработку тестостерона, что помогает сохранить длительное время половую активность и не потерять с возрастом волосы.
Полезны ли огурцы при беременности и грудном вскармливании
В период беременности огурцы не просто разрешены, а обязательны к употреблению. Овощ при вынашивании ребенка помогает женщине предотвратить появление запоров, а также отеков, поскольку устранение лишней жидкости из организма снижает нагрузку на почки и позволяет нормализовать давление. То, что огурцы способствуют выведению лишней жидкости, полезно и для сердечной мышцы.
В то же время после родов в период грудного вскармливания от огурцов лучше отказаться, так как часть веществ из их состава, попадая с молоком к ребенку, спровоцирует у него вздутие живота и колики.
Чем полезен огурец для организма при похудении
Пи похудении овощ позволяет составить низкокалорийную диету и при этом не ограничивать организм в необходимых витаминах и минералах. Улучшая пищеварение и обмен веществ, культура способствует существенному снижению веса.
Низкая калорийность огурца позволяет использовать его в качестве перекуса, так как высокое содержание клетчатки дает длительное ощущение сытости, и в то же время овощ стимулирует сжигание жировых отложений.
Вред и противопоказания употребления
Свежие огурцы, польза и вред которых для организма интересуют многих любителей этого овоща, при умеренном употреблении не навредят. Если же их переесть, то могут возникнуть расстройства пищеварения. Также важно учесть и наличие противопоказаний. Отказаться от употребления культуры необходимо, когда присутствуют:
- тяжелые патологии печени;
- последняя стадия гипертонической болезни;
- атеросклероз;
- заболевания почек;
- грудное кормление.
Даже при противопоказаниях, огурец в малом количестве не принесет вреда и не ухудшит состояние здоровья.
Польза и вред соленых и маринованных огурцов
При соблюдении указанных выше противопоказаний огурцы в соленом и маринованном виде пойдут только на пользу. Соления способствуют устранению патогенных бактерий в микрофлоре кишечника и предупреждают его воспаления и появление эрозий.

Польза соленых огурцов заключается в способности снижать уровень жиров в крови. Это свойство помогает предупредить появление инфарктов и гипертонических кризов. Вред соленый огурец нанесет только при чрезмерном употреблении и не соблюдении противопоказаний.
В маринованном виде употреблять людям овощ рекомендовано для стимуляции иммунитета из-за того, что к его действию добавляется еще и действие пряностей, входящих в состав маринада. При поедании маринованных огурцов, надо помнить о том, что они стимулируют аппетит и могут провоцировать ожирение. Не стоит кормить ими детей в возрасте до 7 лет, так как детский желудочно-кишечный тракт еще недостаточно сформирован, и острые овощи могут вызвать нарушения в его работе.
Соленые и маринованные овощи могут нанести вред людям, у которых наблюдаются:
- язва желудка;
- повышенная кислотность желудка;
- наличие камней в почках.

Мнение эксперта
Садовод-огородник
Задать вопрос экспертуОгурцы показали себя как полезный продукт в любом виде – от свежего до маринованного. Употреблять овощи надо в любом возрасте, но только если подходить к этому правильно. Не стоит недооценивать культуру, считая, что она состоит только из воды.