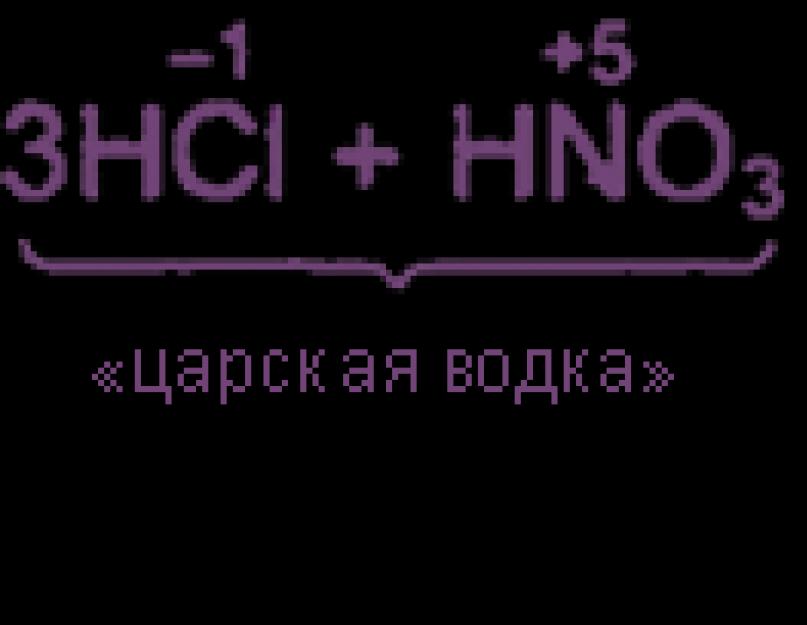Cl 2 au vol. T - gaz jaune-vert à forte odeur suffocante, plus lourd que l'air - 2,5 fois, légèrement soluble dans l'eau (~ 6,5 g / l); X. R dans des solvants organiques non polaires. On le trouve libre uniquement dans les gaz volcaniques.
Comment avoir
Basé sur le processus d'oxydation des anions Cl -
2Cl - - 2e - = Cl 2 0
Industriel
Électrolyse de solutions aqueuses de chlorures, plus souvent - NaCl :
2NaCl + 2H 2 O \u003d Cl 2 + 2NaOH + H 2
Laboratoire
Conc. d'oxydation HCI divers agents oxydants :
4HCI + MnO 2 \u003d Cl 2 + MpCl 2 + 2H 2 O
16HCl + 2KMnO 4 \u003d 5Cl 2 + 2MnCl 2 + 2KCl + 8H 2 O
6HCl + KClO 3 \u003d ZCl 2 + KCl + 3H 2 O
14HCl + K 2 Cr 2 O 7 \u003d 3Cl 2 + 2CrCl 3 + 2KCl + 7H 2 O
Propriétés chimiques
Le chlore est un oxydant très puissant. Oxyde les métaux, les non-métaux et les substances complexes, tout en se transformant en anions très stables Cl - :
Cl 2 0 + 2e - \u003d 2Cl -
Réactions avec les métaux
Les métaux actifs dans une atmosphère de chlore gazeux sec s'enflamment et brûlent; dans ce cas, des chlorures métalliques se forment.
Cl2 + 2Na = 2NaCl
3Cl 2 + 2Fe = 2FeCl 3
Les métaux inactifs sont plus facilement oxydés par le chlore humide ou ses solutions aqueuses :
Cl 2 + Cu \u003d CuCl 2
3Cl 2 + 2Au = 2AuCl 3
Réactions avec des non-métaux
Le chlore n'interagit pas directement uniquement avec O 2, N 2, C. Les réactions se déroulent avec d'autres non-métaux dans diverses conditions.
Des halogénures non métalliques se forment. La plus importante est la réaction d'interaction avec l'hydrogène.
Cl 2 + H 2 \u003d 2HC1
Cl 2 + 2S (fondu) = S 2 Cl 2
ЗCl 2 + 2Р = 2РCl 3 (ou РCl 5 - en excès de Cl 2)
2Cl 2 + Si = SiCl 4
3Cl 2 + I 2 \u003d 2ICl 3
Déplacement des non-métaux libres (Br 2, I 2, N 2, S) de leurs composés
Cl2 + 2KBr = Br2 + 2KCl
Cl 2 + 2KI \u003d I 2 + 2KCl
Cl 2 + 2HI \u003d I 2 + 2HCl
Cl 2 + H 2 S \u003d S + 2HCl
ZCl 2 + 2NH 3 \u003d N 2 + 6HCl
Dismutation du chlore dans l'eau et les solutions aqueuses d'alcalis
À la suite de l'auto-oxydation-auto-guérison, certains atomes de chlore sont convertis en anions Cl -, tandis que d'autres dans un état d'oxydation positif font partie des anions ClO - ou ClO 3 -.
Cl 2 + H 2 O \u003d HCl + HClO hypochloreux to-ta
Cl 2 + 2KOH \u003d KCl + KClO + H 2 O
3Cl 2 + 6KOH = 5KCl + KClO 3 + 3H 2 O
3Cl 2 + 2Ca (OH) 2 \u003d CaCl 2 + Ca (ClO) 2 + 2H 2 O
Ces réactions ont importance, puisqu'ils conduisent à la production de composés oxygénés du chlore :
KClO 3 et Ca(ClO) 2 - hypochlorites; KClO 3 - chlorate de potassium (sel de bertolet).
Interaction du chlore avec des substances organiques
a) substitution d'atomes d'hydrogène dans les molécules OB
b) fixation des molécules de Cl 2 au point de rupture de plusieurs liaisons carbone-carbone
H 2 C \u003d CH 2 + Cl 2 → ClH 2 C-CH 2 Cl 1,2-dichloroéthane
HC≡CH + 2Cl 2 → Cl 2 HC-CHCl 2 1,1,2,2-tétrachloroéthane
Chlorure d'hydrogène et acide chlorhydrique
Chlorure d'hydrogène gazeux
Proprietes physiques et chimiques
HCl est le chlorure d'hydrogène. Au rév. T - incolore. gaz à odeur piquante, se liquéfie assez facilement (pf -114°С, point d'ébullition -85°С). Le HCl anhydre, à la fois à l'état gazeux et liquide, est non conducteur, chimiquement inerte vis-à-vis des métaux, des oxydes et hydroxydes métalliques, ainsi que de nombreuses autres substances. Cela signifie qu'en l'absence d'eau, le chlorure d'hydrogène ne présente pas de propriétés acides. Ce n'est qu'à des températures très élevées que le HCl gazeux réagit avec les métaux, même inactifs comme Cu et Ag.
Les propriétés réductrices de l'anion chlorure dans HCl se manifestent également dans une faible mesure : il est oxydé par le fluor en vol. T, et aussi à haute T (600°C) en présence de catalyseurs, il réagit de manière réversible avec l'oxygène :
2HCl + F 2 \u003d Cl 2 + 2HF
4HCl + O 2 \u003d 2Cl 2 + 2H 2 O
L'HCl gazeux est largement utilisé en synthèse organique (réactions d'hydrochloration).
Comment avoir
1. Synthèse à partir de substances simples :
H 2 + Cl 2 \u003d 2HCl
2. Formé comme sous-produit lors de la chloration des hydrocarbures :
R-H + Cl 2 = R-Cl + HCl
3. Au laboratoire, ils reçoivent l'action de conc. H 2 SO 4 pour les chlorures :
H 2 SO 4 (conc.) + NaCl \u003d 2HCl + NaHSO 4 (à faible chauffage)
H 2 SO 4 (conc.) + 2NaCl \u003d 2HCl + Na 2 SO 4 (avec très fort chauffage)
Une solution aqueuse de HCl est un acide fort (chlorhydrique ou chlorhydrique)
HCl est très soluble dans l'eau : à vol. T dans 1 l de H 2 O dissout ~ 450 l de gaz (la dissolution s'accompagne du dégagement d'une quantité importante de chaleur). Une solution saturée a une fraction massique de HCl égale à 36-37%. Cette solution a une odeur très piquante et suffocante.
Les molécules de HCl dans l'eau se décomposent presque complètement en ions, c'est-à-dire qu'une solution aqueuse de HCl est un acide fort.
Propriétés chimiques de l'acide chlorhydrique
1. HCl dissous dans l'eau présente toutes les propriétés générales des acides en raison de la présence d'ions H +
HCl → H + + Cl -
Interaction:
a) avec des métaux (jusqu'à H):
2HCl 2 + Zn \u003d ZnCl 2 + H 2
b) avec des oxydes basiques et amphotères :
2HCl + CuO \u003d CuCl 2 + H 2 O
6HCl + Al 2 O 3 \u003d 2AlCl 3 + ZN 2 O
c) avec des bases et des hydroxydes amphotères :
2HCl + Ca(OH) 2 \u003d CaCl 2 + 2H 2 O
3HCl + Al(OH) 3 \u003d AlCl 3 + ZN 2 O
d) avec des sels d'acides plus faibles :
2HCl + CaCO 3 \u003d CaCl 2 + CO 2 + H 3 O
HCl + C 6 H 5 ONa \u003d C 6 H 5 OH + NaCl
e) avec de l'ammoniac :
HCl + NH 3 \u003d NH 4 Cl
Réactions avec les agents oxydants forts F 2 , MnO 2 , KMnO 4 , KClO 3 , K 2 Cr 2 O 7 . L'anion Cl - est oxydé en halogène libre :
2Cl - - 2e - = Cl 2 0
Pour les équations de réaction, voir "Obtenir du chlore". L'OVR entre les acides chlorhydrique et nitrique revêt une importance particulière :

Réactions avec des composés organiques
Interaction:
a) avec des amines (comme bases organiques)
R-NH 2 + HCl → + Cl -
b) avec des acides aminés (en tant que composés amphotères)

Oxydes et oxoacides de chlore
Oxydes acides

acides

sel
Propriétés chimiques
1. Tous les oxoacides de chlore et leurs sels sont de puissants oxydants.
2. Presque tous les composés se décomposent lorsqu'ils sont chauffés en raison d'une oxydo-réduction intramoléculaire ou d'une dismutation.

Poudre blanchissante
La chaux chlorée (blanchiment) - un mélange d'hypochlorite et de chlorure de calcium, a un effet blanchissant et désinfectant. Parfois, il est considéré comme un exemple de sel mixte, qui contient simultanément des anions de deux acides :

Eau de Javel
Solution aqueuse de chlorure et d'hapochlorite de potassium KCl + KClO + H 2 O
Ministère de l'Éducation et des Sciences de la FÉDÉRATION DE RUSSIE
ÉTABLISSEMENT D'ENSEIGNEMENT D'ÉTAT FÉDÉRAL DE L'ENSEIGNEMENT PROFESSIONNEL SUPÉRIEUR
UNIVERSITÉ CHIMIQUE ET TECHNOLOGIQUE D'ÉTAT D'IVANOVSK
Département des TP et MET
Essai
Chlore : propriétés, application, production
Responsable : Efremov A.M.
Ivanovo 2015
Introduction
Informations générales sur le chlore
Application de chlore
Méthodes chimiques de production de chlore
Électrolyse. Le concept et l'essence du processus
Production industrielle chlore
Sécurité dans la production de chlore et protection de l'environnement
Conclusion
Introduction
électrolyse de l'élément chimique du chlore
En raison de l'ampleur de l'utilisation du chlore dans divers domaines de la science, de l'industrie, de la médecine et de la vie quotidienne, la demande en a récemment augmenté de façon spectaculaire. Il existe de nombreuses méthodes d'obtention de chlore par des méthodes de laboratoire et industrielles, mais elles présentent toutes plus d'inconvénients que d'avantages. Obtenir du chlore, par exemple, à partir d'acide chlorhydrique, qui est un sous-produit et un déchet de nombreuses industries chimiques et autres, ou sel de table, extrait dans des gisements de sel, le procédé est assez énergivore, nocif du point de vue de l'écologie et très dangereux pour la vie et la santé.
À l'heure actuelle, le problème du développement d'une technologie de production de chlore, qui éliminerait tous les inconvénients ci-dessus, et aurait également un rendement élevé en chlore, est très urgent.
.Informations générales sur le chlore
Le chlore a été obtenu pour la première fois en 1774 par K. Scheele par l'interaction de l'acide chlorhydrique avec la pyrolusite MnO2. Cependant, ce n'est qu'en 1810 que G. Davy a établi que le chlore est un élément et l'a nommé chlore (du grec chloros - jaune-vert). En 1813, J. L. Gay-Lussac proposa le nom "Chlore" pour cet élément.
Le chlore est un élément du groupe VII du tableau périodique des éléments de D. I. Mendeleïev. Poids moléculaire 70,906, poids atomique 35,453, numéro atomique 17, appartient à la famille des halogènes. Dans des conditions normales, le chlore libre, composé de molécules diatomiques, est un gaz jaune verdâtre ininflammable avec une odeur piquante et irritante caractéristique. Il est toxique et provoque la suffocation. Le chlore gazeux comprimé à pression atmosphérique se transforme en liquide couleur ambreà -34,05 °C, durcit à -101,6 °C et une pression de 1 atm. Généralement, le chlore est un mélange de 75,53 % de 35Cl et de 24,47 % de 37Cl. Dans des conditions normales, la densité du chlore gazeux est de 3,214 kg/m3, soit environ 2,5 fois plus lourd que l'air.
Chimiquement, le chlore est très actif, il se combine directement avec presque tous les métaux (certains uniquement en présence d'humidité ou lorsqu'ils sont chauffés) et avec les non-métaux (sauf le carbone, l'azote, l'oxygène, les gaz inertes), formant les chlorures correspondants, réagit avec de nombreux composés, remplace l'hydrogène dans les hydrocarbures saturés et rejoint les composés insaturés. Cela est dû à la grande variété de ses applications. Le chlore déplace le brome et l'iode de leurs composés avec l'hydrogène et les métaux. Les métaux alcalins en présence de traces d'humidité interagissent avec le chlore avec inflammation, la plupart des métaux réagissent avec le chlore sec uniquement lorsqu'ils sont chauffés. L'acier, ainsi que certains métaux, résistent au chlore sec à basse température, ils sont donc utilisés pour la fabrication d'équipements et le stockage du chlore sec. Le phosphore s'enflamme dans une atmosphère de chlore, formant РCl3, et lors d'une chloration supplémentaire - РCl5. Le soufre avec le chlore, lorsqu'il est chauffé, donne S2Cl2, SCl2 et d'autres SnClm. L'arsenic, l'antimoine, le bismuth, le strontium, le tellure interagissent vigoureusement avec le chlore. Un mélange de chlore et d'hydrogène brûle avec une flamme incolore ou jaune-vert pour former du chlorure d'hydrogène (c'est une réaction en chaîne). La température maximale de la flamme hydrogène-chlore est de 2200°C. Les mélanges de chlore avec de l'hydrogène, contenant de 5,8 à 88,5 % de H2, sont explosifs et peuvent exploser sous l'action de la lumière, d'une étincelle électrique, du chauffage, de la présence de certaines substances, comme les oxydes de fer.
Avec l'oxygène, le chlore forme des oxydes : Cl2O, ClO2, Cl2O6, Cl2O7, Cl2O8, ainsi que des hypochlorites (sels de l'acide hypochloreux), des chlorites, des chlorates et des perchlorates. Tous les composés oxygénés du chlore forment des mélanges explosifs avec des substances facilement oxydables. Les oxydes de chlore sont instables et peuvent exploser spontanément, les hypochlorites se décomposent lentement pendant le stockage, les chlorates et les perchlorates peuvent exploser sous l'influence d'initiateurs. Le chlore dans l'eau est hydrolysé, formant des acides hypochloreux et chlorhydrique : Cl2 + H2O ? HClO + HCl. La solution jaunâtre qui en résulte est souvent appelée eau chlorée. Lors de la chloration de solutions aqueuses d'alcalis à froid, des hypochlorites et des chlorures se forment: 2NaOH + Cl2 \u003d NaClO + NaCl + H2O, et lorsqu'ils sont chauffés - des chlorates. Par chloration de l'hydroxyde de calcium sec, on obtient un agent de blanchiment. Lorsque l'ammoniac réagit avec le chlore, il se forme du trichlorure d'azote. Lors de la chloration des composés organiques, le chlore remplace l'hydrogène ou s'ajoute via des liaisons multiples, formant divers composés organiques contenant du chlore. Le chlore forme des composés interhalogènes avec d'autres halogènes. Les fluorures de chlore ClF, ClF3, ClF3 sont très réactifs ; par exemple, dans une atmosphère ClF3, la laine de verre s'enflamme spontanément. Les composés chlorés avec l'oxygène et le fluor sont connus - les oxyfluorures de chlore : ClO3F, ClO2F3, ClOF, ClOF3 et le perchlorate de fluor FClO4.
Le chlore n'est présent dans la nature que sous forme de composés. Sa teneur moyenne dans la croûte terrestre est de 1,7 10-2 % en poids. La migration de l'eau joue un rôle majeur dans l'histoire du chlore dans la croûte terrestre. Sous forme de Cl-ion, on le trouve dans l'océan mondial (1,93%), les saumures souterraines et les lacs salés. Le nombre de minéraux natifs (principalement des chlorures naturels) est de 97, le principal étant l'halite NaCl ( Sel gemme). Il existe également d'importants gisements de chlorures et de chlorures mixtes de potassium et de magnésium : sylvine KCl, sylvinite (Na,K)Cl, carnalite KCl MgCl2 6H2O, kaïnite KCl MgSO4 3H2O, bischofite MgCl2 6H2O. Dans l'histoire de la Terre, l'apport de HCl contenu dans les gaz volcaniques aux parties supérieures de la croûte terrestre a été d'une grande importance.
Normes de qualité du chlore
Nom de l'index GOST 6718-93Haute qualitéPremière qualitéFraction volumique de chlore, pas moins de %99.899.6Fraction massique d'eau, pas plus de %0.010.04Fraction massique de trichlorure d'azote, pas plus de %0.0020.004Fraction massique de non volatil résidu, pas plus,%0 .0150.10
Stockage et transport du chlore
Le chlore produit par diverses méthodes est stocké dans des "réservoirs" spéciaux ou pompé dans des cylindres en acier cylindriques (volume 10-250 m3) et sphériques (volume 600-2000 m3) sous une pression de vapeurs propres de 18 kgf/cm2. Les volumes de stockage maximum sont de 150 tonnes. Les bouteilles de chlore liquide sous pression ont une couleur spéciale - couleur protectrice. En cas de dépressurisation d'une bouteille de chlore, un dégagement brutal de gaz se produit avec une concentration plusieurs fois supérieure à celle létale. Il convient de noter que les bouteilles de chlore ont tendance à accumuler du trichlorure d'azote hautement explosif sur de longues périodes et que, par conséquent, les bouteilles de chlore doivent être régulièrement rincées et purgées du chlorure d'azote de temps en temps. Le chlore est transporté dans des conteneurs, citernes ferroviaires, bouteilles, qui constituent son stockage temporaire.
2.Application de chlore
Le chlore est principalement consommé industrie chimique pour la production de divers dérivés chlorés organiques utilisés pour la production de plastiques, de caoutchoucs synthétiques, de fibres chimiques, de solvants, d'insecticides, etc. Actuellement, plus de 60 % de la production mondiale de chlore est utilisée pour la synthèse organique. De plus, le chlore est utilisé pour produire de l'acide chlorhydrique, de l'eau de Javel, des chlorates et d'autres produits. Des quantités importantes de chlore sont utilisées en métallurgie pour la chloration dans le traitement des minerais polymétalliques, l'extraction de l'or des minerais, et il est également utilisé dans l'industrie du raffinage du pétrole, en agriculture, dans la médecine et l'assainissement, pour la neutralisation des eaux potables et usées, dans la pyrotechnie et un certain nombre d'autres domaines de l'économie nationale. Conséquence du développement des usages du chlore, principalement dû au succès de la synthèse organique, la production mondiale de chlore est de plus de 20 millions de tonnes/an.
Les principaux exemples d'application et d'utilisation du chlore dans diverses branches de la science, de l'industrie et des besoins domestiques:
1.dans la production de chlorure de polyvinyle, de composés plastiques, de caoutchouc synthétique, qui sont utilisés pour fabriquer : des isolants pour fils, des profilés de fenêtre, des matériaux d'emballage, des vêtements et des chaussures, des disques de linoléum et de gramophone, des vernis, des équipements et des plastiques en mousse, des jouets, des pièces d'instruments, matériaux de construction. Le chlorure de polyvinyle est produit par la polymérisation du chlorure de vinyle, qui est aujourd'hui le plus souvent préparé à partir d'éthylène dans un procédé équilibré en chlore via un intermédiaire 1,2-dichloroéthane.
CH2=CH2+Cl2=>CH2Cl-CH2ClCl-CH2Cl=> CH2=CHCl+HCl
1)comme agent de blanchiment (bien que ce ne soit pas le chlore lui-même qui "blanchisse", mais l'oxygène atomique, qui se forme lors de la décomposition de l'acide hypochloreux selon la réaction : Cl2 + H2O ? HCl + HClO ? 2HCl + O*).
2)dans la production d'insecticides organochlorés - substances qui tuent les insectes nuisibles aux cultures, mais qui sont sans danger pour les plantes (aldrine, DDT, hexachlorane). L'un des insecticides les plus importants est l'hexachlorocyclohexane (C6H6Cl6).
)utilisé comme agent de guerre chimique, ainsi que pour la production d'autres agents de guerre chimique : gaz moutarde (C4H8Cl2S), phosgène (CCl2O).
)pour la désinfection de l'eau - "chloration". La méthode la plus courante de désinfection de l'eau potable est basée sur la capacité du chlore libre et de ses composés à inhiber les systèmes enzymatiques des micro-organismes qui catalysent les processus redox. Pour la désinfection de l'eau potable, le chlore (Cl2), le dioxyde de chlore (ClO2), la chloramine (NH2Cl) et l'eau de Javel (Ca(Cl)OCl) sont utilisés.
)enregistré dans l'industrie alimentaire comme additif alimentaire E925.
)dans la production chimique de soude caustique (NaOH) (utilisée dans la production de rayonne, dans l'industrie du savon), d'acide chlorhydrique (HCl), d'eau de Javel, de chlorure de chlore (KClO3), de chlorures métalliques, de poisons, de médicaments, d'engrais.
)en métallurgie pour la production de métaux purs : titane, étain, tantale, niobium.
TiO2 + 2C + 2Cl2 => TiCl4 + 2CO ;
TiCl4 + 2Mg => 2MgCl2 + Ti (à Т=850°С)
)comme indicateur des neutrinos solaires dans les détecteurs chlore-argon (L'idée d'un "détecteur de chlore" pour détecter les neutrinos solaires a été proposée par le célèbre physicien soviétique Académicien B. Pontecorvo et mise en œuvre par le physicien américain R. Davis et ses collègues. Après avoir capturé le noyau neutrino de l'isotope chlore d'un poids atomique de 37, il se transforme en un noyau de l'isotope argon-37, avec la formation d'un électron qui peut être enregistré.).
De nombreux pays développés s'efforcent de limiter l'utilisation du chlore dans la vie de tous les jours, notamment parce que la combustion des déchets contenant du chlore produit une quantité importante de dioxines (écotoxiques mondiaux au pouvoir mutagène puissant).
3. Méthodes chimiques de production de chlore
Auparavant, la production de chlore était très répandue chimiquement selon les méthodes de Weldon et Deacon. Dans ces procédés, le chlore était produit par l'oxydation du chlorure d'hydrogène formé comme sous-produit de la production de sulfate de sodium à partir de chlorure de sodium par l'action de l'acide sulfurique.
la réaction se déroule lors de l'utilisation de la méthode Weldon :
4HCl + MnO2 => MnCl2 + 2H2O + Cl2
la réaction se déroule lors de l'utilisation de la méthode Deacon :
HCl + O2 => 2H2O + 2Cl2
Dans le procédé Deacon, le chlorure de cuivre a été utilisé comme catalyseur, dont une solution à 50% (parfois avec l'ajout de NaCl) a été imprégnée dans un support céramique poreux. La température de réaction optimale sur un tel catalyseur était habituellement de l'ordre de 430 à 490°. Ce catalyseur est facilement empoisonné par les composés d'arsenic, avec lesquels il forme de l'arséniate de cuivre inactif, ainsi que par le dioxyde et le trioxyde de soufre. La présence de vapeurs d'acide sulfurique même en faible quantité dans le gaz provoque une forte diminution du rendement en chlore par suite de réactions successives :
H2SO4 => SO2 + 1/2O2 + H2O+ С12 + 2Н2O => 2НCl + H2SO4
С12 + Н2O => 1/2O2 + 2НCl
Ainsi, l'acide sulfurique est un catalyseur qui favorise la conversion inverse de Cl2 en HCl. Par conséquent, avant l'oxydation sur un catalyseur au cuivre, le gaz chlorhydrique doit être soigneusement purifié des impuretés qui réduisent le rendement en chlore.
L'installation de Deacon consistait en un réchauffeur de gaz, un filtre à gaz et un appareil de contact d'un boîtier cylindrique en acier, à l'intérieur duquel se trouvaient deux cylindres en céramique disposés concentriquement avec des trous; l'espace annulaire entre eux est rempli d'un catalyseur. Le chlorure d'hydrogène a été oxydé avec de l'air, donc le chlore a été dilué. Un mélange contenant 25 % en volume de HCl et 75 % en volume d'air (~16 % d'O2) a été introduit dans l'appareil de contact, et le gaz sortant de l'appareil contenait environ 8 % de C12, 9 % de HCl, 8 % de vapeur d'eau et 75 % air . Un tel gaz, après lavage avec HCl et séchage avec de l'acide sulfurique, était généralement utilisé pour obtenir de l'eau de Javel.
La restauration du procédé Deacon repose actuellement sur l'oxydation du chlorure d'hydrogène non pas avec de l'air, mais avec de l'oxygène, ce qui permet d'obtenir du chlore concentré à l'aide de catalyseurs très actifs. Le mélange chloro-oxygène résultant est lavé des résidus HCl successivement avec 36 et 20% acide hydrochlorique et séché avec de l'acide sulfurique. Le chlore est ensuite liquéfié et l'oxygène est réinjecté dans le procédé. La séparation du chlore de l'oxygène s'effectue également en absorbant le chlore sous une pression de 8 atm avec du chlorure de soufre, qui est ensuite régénéré pour obtenir du chlore à 100 % :
Сl2 + S2CI2
Des catalyseurs à basse température sont utilisés, par exemple le dichlorure de cuivre activé avec des sels de métaux de terres rares, ce qui permet de réaliser le procédé même à 100°C et donc d'augmenter fortement le degré de conversion de HCl en Cl2. Sur un catalyseur à l'oxyde de chrome, la combustion de HCl dans l'oxygène est réalisée à 340480°C. L'utilisation d'un catalyseur à partir d'un mélange de V2O5 avec des pyrosulfates de métaux alcalins et des activateurs sur du gel de silice est décrite. Le mécanisme et la cinétique de ce processus ont été étudiés et conditions optimales sa mise en oeuvre, notamment en lit fluidisé.
L'oxydation du chlorure d'hydrogène par l'oxygène est également réalisée à l'aide d'un mélange fondu de FeCl3 + KCl en deux étapes, réalisées dans des réacteurs séparés. Dans le premier réacteur, le chlorure ferrique est oxydé pour former du chlore :
2FeCl3 + 1
Dans le deuxième réacteur, le chlorure ferrique est régénéré à partir d'oxyde de fer avec du chlorure d'hydrogène :
O3 + 6HCI = 2FeCl3 + 3H20
Pour réduire la pression de vapeur du chlorure ferrique, du chlorure de potassium est ajouté. Il est également proposé de réaliser ce procédé dans un appareil, dans lequel la masse de contact, constituée de Fe2O3, KC1 et de chlorure de cuivre, cobalt ou nickel déposé sur un support inerte, se déplace de haut en bas de l'appareil. Au sommet de l'appareil, il passe une zone chaude de chloration, où Fe2Oz est converti en FeCl3, interagissant avec HCl, qui se trouve dans le flux de gaz allant de bas en haut. Ensuite, la masse de contact descend dans la zone de refroidissement, où le chlore élémentaire se forme sous l'action de l'oxygène, et FeCl3 passe dans Fe2O3. La masse de contact oxydée retourne à nouveau dans la zone de chloration.
Une oxydation indirecte similaire de HCl en Cl2 est réalisée selon le schéma :
2HC1 + MgO = MgCl2 + H2O
Il est proposé d'obtenir simultanément du chlore et de l'acide sulfurique en faisant passer un gaz contenant HCl, O2 et un large excès de SO2 à travers un catalyseur au vanadium à 400-600°C. Ensuite, H2SO4 et HSO3Cl sont condensés à partir du gaz et SO3 est absorbé par l'acide sulfurique ; le chlore reste dans la phase gazeuse. HSO3Cl est hydrolysé et le HC1 libéré est réinjecté dans le procédé.
Une oxydation encore plus efficace est réalisée par des agents oxydants tels que PbO2, KMnO4, KClO3, K2Cr2O7 :
2KMnO4 + 16HCl => 2KCl + 2MnCl2 + 5Cl2^ +8H2O
Le chlore peut également être obtenu par oxydation des chlorures. Par exemple, lorsque NaCl et SO3 interagissent, des réactions se produisent :
NaCl + 2SO3 = 2NaSO3Cl
NaSO3Cl = Cl2 + SO2 + Na2SO4
La décomposition de NaSO3Cl se produit à 275°C. Un mélange de gaz SO2 et C12 peut être séparé en absorbant le chlore SO2Cl2 ou CCl4 ou en le soumettant à une rectification, ce qui donne un mélange azéotropique contenant 88 mol. % Cl2 et 12 mol. %SO2. Le mélange azéotropique peut être encore séparé en convertissant SO2 en SO2C12 et en séparant l'excès de chlore, et en décomposant SO2Cl2 à 200° en SO2 et Cl2, qui sont ajoutés au mélange envoyé pour rectification.
Le chlore peut être obtenu en oxydant du chlorure ou du chlorure d'hydrogène avec de l'acide nitrique, ainsi que du dioxyde d'azote :
ZHCl + HNO3 => Сl2 + NOCl + 2Н2O
Une autre façon d'obtenir du chlore est la décomposition du chlorure de nitrosyle, qui peut être obtenue par son oxydation :
NOCl + O2 = 2NO2 + Сl2
Aussi, pour obtenir du chlore, il est proposé, par exemple, d'oxyder le NOCl avec de l'acide nitrique à 75 % :
2NOCl + 4HNO3 = Сl2 + 6NO2 + 2Н2O
Un mélange de chlore et de dioxyde d'azote est séparé en convertissant NO2 en acide nitrique faible, qui est ensuite utilisé pour oxyder HCl dans la première étape du procédé pour former Cl2 et NOCl. La principale difficulté dans la mise en oeuvre de ce procédé à l'échelle industrielle est l'élimination de la corrosion. La céramique, le verre, le plomb, le nickel et les plastiques sont utilisés comme matériaux pour les équipements. Selon cette méthode aux USA en 1952-1953. l'usine fonctionnait avec une capacité de 75 tonnes de chlore par jour.
Une méthode cyclique a été mise au point pour la production de chlore par oxydation du chlorure d'hydrogène par l'acide nitrique sans formation de chlorure de nitrosyle selon la réaction :
2НCl + 2HNO3 = Сl2 + 2NO2 + 2Н2O
Le procédé se déroule en phase liquide à 80°C, le rendement en chlore atteint 100%, le NO2 est obtenu sous forme liquide.
Par la suite, ces méthodes ont été complètement remplacées par des méthodes électrochimiques, mais à l'heure actuelle, les méthodes chimiques de production de chlore sont à nouveau relancées sur une nouvelle base technique. Tous sont basés sur l'oxydation directe ou indirecte de l'HCl (ou des chlorures), l'agent oxydant le plus courant étant l'oxygène atmosphérique.
Électrolyse. Le concept et l'essence du processus
L'électrolyse est un ensemble de processus électrochimiques redox qui se produisent sur les électrodes lors du passage d'un courant électrique constant à travers une masse fondue ou une solution avec des électrodes immergées dedans.
Riz. 4.1. Processus se produisant pendant l'électrolyse. Schéma du bain d'électrolyse : 1 - bain, 2 - électrolyte, 3 - anode, 4 - cathode, 5 - alimentation
Les électrodes peuvent être n'importe quel matériau conducteur d'électricité. Les métaux et alliages sont principalement utilisés, à partir des non-métaux, par exemple, des tiges de graphite (ou de carbone) peuvent servir d'électrodes. Moins fréquemment, des liquides sont utilisés comme électrode. Une électrode chargée positivement est une anode. L'électrode chargée négativement est la cathode. Lors de l'électrolyse, l'anode est oxydée (elle se dissout) et la cathode est réduite. C'est pourquoi l'anode doit être prise de manière à ce que sa dissolution n'affecte pas procédé chimique s'écoulant en solution ou en fusion. Une telle anode est appelée électrode inerte. En tant qu'anode inerte, vous pouvez prendre du graphite (carbone) ou du platine. En tant que cathode, vous pouvez prendre une plaque de métal (elle ne se dissoudra pas). Cuivre, laiton, carbone (ou graphite), zinc, fer, aluminium, acier inoxydable.
Exemples d'électrolyse de masses fondues :
Exemples d'électrolyse de solutions salines :
(Les anions Cl? sont oxydés à l'anode, et non l'oxygène O? II des molécules d'eau, puisque l'électronégativité du chlore est inférieure à celle de l'oxygène, et donc, le chlore dégage plus facilement des électrons que l'oxygène)
L'électrolyse de l'eau est toujours réalisée en présence d'un électrolyte inerte (pour augmenter la conductivité électrique d'un électrolyte très faible - l'eau) :
Selon l'électrolyte inerte, l'électrolyse est réalisée en milieu neutre, acide ou alcalin. Lors du choix d'un électrolyte inerte, il faut tenir compte du fait que les cations métalliques qui sont des agents réducteurs typiques (par exemple, Li +, Cs +, K +, Ca2 +, Na +, Mg2 +, Al3 +) ne sont jamais réduits à la cathode dans une solution aqueuse et l'oxygène O? II des anions d'acide oxo n'est jamais oxydé à l'anode avec un élément à l'état d'oxydation le plus élevé (par exemple, ClO4?, SO42?, NO3?, PO43?, CO32?, SiO44? , MnO4?), l'eau est plutôt oxydée.
L'électrolyse comprend deux processus : la migration de particules réagissant sous l'action d'un champ électrique à la surface de l'électrode et le transfert de charge d'une particule à une électrode ou d'une électrode à une particule. La migration des ions est déterminée par leur mobilité et leur nombre de transfert. Le processus de transfert de plusieurs charges électriques s'effectue généralement sous la forme d'une séquence de réactions à un électron, c'est-à-dire par étapes, avec formation de particules intermédiaires (ions ou radicaux), qui existent parfois pour quelque temps sur l'électrode dans un état adsorbé.
Les taux de réactions des électrodes dépendent de :
composition électrolytique
concentration d'électrolytes
matériau d'électrode
le potentiel de l'électrode
température
conditions hydrodynamiques.
La mesure de la vitesse de réaction est la densité de courant. Il s'agit d'un vecteur physique dont le module est déterminé par le rapport de l'intensité du courant (le nombre de charges électriques transférées par unité de temps) dans le conducteur à la section transversale.
Les lois de Faraday de l'électrolyse sont ratios quantitatifs, basées sur des études électrochimiques, et aident à déterminer la masse des produits formés lors de l'électrolyse. Dans la plupart vue générale lois sont formulées comme suit :
)Première loi de Faraday sur l'électrolyse : la masse d'une substance déposée sur une électrode pendant l'électrolyse est directement proportionnelle à la quantité d'électricité transférée à cette électrode. La quantité d'électricité fait référence à la charge électrique, généralement mesurée en coulombs.
2)Deuxième loi de Faraday sur l'électrolyse : pour une quantité donnée d'électricité (charge électrique), la masse élément chimique déposée sur l'électrode est directement proportionnelle à la masse équivalente de l'élément. La masse équivalente d'une substance est sa masse molaire divisée par un nombre entier, en fonction de la réaction chimique à laquelle la substance participe.
Sous forme mathématique, les lois de Faraday peuvent être représentées comme suit :
où m est la masse de la substance déposée sur l'électrode en grammes, est la charge électrique totale qui a traversé la substance, = 96 485,33 (83) C mol ? 1 est la constante de Faraday, est la masse molaire de la substance ( Par exemple, la masse molaire de l'eau H2O = 18 g / mol), - le nombre de valence des ions d'une substance (le nombre d'électrons par ion).
A noter que M/z est la masse équivalente de la matière déposée.
Pour la première loi de Faraday, M, F et z sont des constantes, donc plus la valeur Q est grande, plus la valeur m est grande.
Pour la deuxième loi de Faraday, Q, F et z sont des constantes, donc plus la valeur de M/z (masse équivalente) est grande, plus la valeur de m est grande.
Dans le cas le plus simple, l'électrolyse à courant continu entraîne :
Dans un cas plus complexe de courant électrique alternatif, la charge totale Q du courant I( ?) est additionné dans le temps ? :
où t- à temps pleinélectrolyse.
Dans l'industrie, le processus d'électrolyse est effectué dans des appareils spéciaux - des électrolyseurs.
Production industrielle de chlore
Actuellement, le chlore est principalement produit par électrolyse de solutions aqueuses, à savoir l'une des
Les matières premières pour la production électrolytique de chlore sont principalement des solutions de NaCl obtenues par dissolution de sel solide, ou des saumures naturelles. Il existe trois types de gisements de sel : le sel fossile (environ 99 % des réserves) ; lacs salés avec sédiments de fond de sel d'auto-selle (0,77%); le reste est des divisions souterraines. Les solutions salines, quelle que soit la manière dont elles sont obtenues, contiennent des impuretés qui aggravent le processus d'électrolyse. Les cations calcium Ca2+, Mg2+ et les anions SO42- ont un effet particulièrement défavorable lors de l'électrolyse avec une cathode solide, et les impuretés de composés contenant des métaux lourds, tels que le chrome, le vanadium, le germanium et le molybdène, ont un effet lors de l'électrolyse avec une cathode liquide.
sel de cristal pour l'électrolyse du chlore doit avoir la composition suivante (%) : chlorure de sodium pas moins de 97,5 ; Mg2+ pas plus de 0,05 ; sédiments insolubles pas plus de 0,5 ; Ca2+ pas plus de 0,4 ; K+ pas plus de 0,02 ; SO42 - pas plus de 0,84 ; humidité pas plus de 5 ; impureté de métaux lourds (déterminée par l'échantillon d'amalgame cm3 H2) pas plus de 0,3. Le nettoyage des saumures est réalisé avec une solution de soude (Na2CO3) et de lait de chaux (suspension d'une suspension de Ca(OH)2 dans l'eau). En plus de la purification chimique, les solutions sont débarrassées des impuretés mécaniques par sédimentation et filtration.
L'électrolyse des solutions de sels communs est réalisée dans des bains à cathode solide en fer (ou en acier) et à diaphragmes et membranes, dans des bains à cathode à mercure liquide. Les électrolyseurs industriels utilisés pour l'équipement des grandes usines de chlore modernes doivent avoir une productivité élevée, une conception simple, être compacts, fonctionner de manière fiable et stable.
L'électrolyse se déroule selon le schéma:
MeCl + H2O => MeOH + Cl2 + H2,
où Me est un métal alcalin.
Lors de la décomposition électrochimique du sel de table dans les électrolyseurs à électrodes solides, les principales réactions ioniques réversibles et irréversibles suivantes se produisent :
dissociation des molécules de sel et d'eau (va dans l'électrolyte)
NaCl-Na++Cl-
Oxydation des ions chlore (à l'anode)
C1- - 2e- => C12
réduction des ions hydrogène et des molécules d'eau (à la cathode)
H+ - 2e- => H2
H2O - 2e - \u003d\u003e H2 + 2OH-
Association d'ions dans une molécule d'hydroxyde de sodium (dans l'électrolyte)
Na+ + OH- - NaOH
Les produits utiles sont l'hydroxyde de sodium, le chlore et l'hydrogène. Tous sont retirés de l'électrolyseur séparément.
Riz. 5.1. Schéma d'un électrolyseur à membrane
La cavité de la cellule avec une cathode solide (Fig. 3) est divisée par un poreux
Les premiers électrolyseurs industriels fonctionnaient en batch. Les produits d'électrolyse qu'ils contenaient étaient séparés par un diaphragme en ciment. Par la suite, des électrolyseurs ont été créés, dans lesquels des cloisons en forme de cloche servaient à séparer les produits d'électrolyse. À l'étape suivante, des électrolyseurs à diaphragme d'écoulement sont apparus. Dans ceux-ci, le principe du contre-courant était combiné à l'utilisation d'un diaphragme de séparation en carton d'amiante. De plus, une méthode a été découverte pour obtenir un diaphragme à partir de pâte d'amiante, empruntée à la technologie de l'industrie papetière. Cette méthode a permis de développer des conceptions d'électrolyseurs pour une grande charge de courant avec une cathode à doigt compacte non séparable. Pour augmenter la durée de vie d'un diaphragme en amiante, il est proposé d'introduire dans sa composition des matériaux synthétiques sous forme de revêtement ou de liant. Il est également proposé de fabriquer des diaphragmes entièrement à partir de nouveaux matériaux synthétiques. Il est prouvé que ces diaphragmes combinés amiante-synthétique ou synthétiques spécialement fabriqués ont une durée de vie allant jusqu'à 500 jours. Des diaphragmes échangeurs d'ions spéciaux sont également en cours de développement, qui permettent d'obtenir de la soude caustique pure à très faible teneur en chlorure de sodium. L'action de tels diaphragmes repose sur l'utilisation de leurs propriétés sélectives pour le passage de divers ions.
Les points de contact des conducteurs de courant avec les anodes en graphite dans les premières conceptions ont été retirés de la cavité de la cellule. Plus tard, des méthodes ont été développées pour protéger les parties de contact des anodes immergées dans l'électrolyte. En utilisant ces techniques, des électrolyseurs industriels à plus faible alimentation en courant ont été créés, dans lesquels les contacts d'anode sont situés dans la cavité de l'électrolyseur. Ils sont utilisés partout à l'heure actuelle pour la production de chlore et de caustique sur cathode solide.
Un courant de solution saturée de chlorure de sodium (saumure purifiée) s'écoule en continu dans l'espace anodique de la cellule à diaphragme. À la suite du processus électrochimique, du chlore est libéré à l'anode en raison de la décomposition du sel commun et de l'hydrogène est libéré à la cathode en raison de la décomposition de l'eau. Le chlore et l'hydrogène sont éliminés de l'électrolyseur, sans mélange, séparément. Dans ce cas, la zone proche de la cathode est enrichie en soude. La solution de la zone cathodique, appelée liqueur électrolytique, contenant du sel de table non décomposé (environ la moitié de la quantité fournie avec la saumure) et de l'hydroxyde de sodium, est retirée en continu de l'électrolyseur. À l'étape suivante, la liqueur électrolytique est évaporée et la teneur en NaOH est ajustée à 42-50% conformément à la norme. Le sel de table et le sulfate de sodium précipitent avec une concentration croissante d'hydroxyde de sodium.
La solution de NaOH est décantée des cristaux et passée comme produit finià un entrepôt ou à l'étape de la fusion caustique pour obtenir produit solide. Le sel de table cristallin (sel inverse) est renvoyé à l'électrolyse, en préparant ce que l'on appelle la saumure inverse. De là, afin d'éviter l'accumulation de sulfate dans les solutions, le sulfate est extrait avant de préparer la saumure de retour. La perte de sel de table est compensée par l'ajout de saumure fraîche obtenue par lixiviation souterraine des couches de sel ou par dissolution de sel de table solide. Avant d'être mélangée à la saumure inverse, la saumure fraîche est débarrassée des suspensions mécaniques et d'une partie importante des ions calcium et magnésium. Le chlore résultant est séparé de la vapeur d'eau, comprimé et transféré soit directement aux consommateurs, soit pour liquéfier le chlore. L'hydrogène est séparé de l'eau, comprimé et transféré aux consommateurs.
Les mêmes réactions chimiques ont lieu dans un électrolyseur à membrane que dans un électrolyseur à membrane. Au lieu d'un diaphragme poreux, une membrane cationique est utilisée (Fig. 5).
Riz. 5.2. Schéma d'un électrolyseur à membrane
La membrane empêche la pénétration des ions chlore dans le catholyte (électrolyte dans l'espace cathodique), grâce à quoi la soude caustique peut être obtenue directement dans l'électrolyseur presque sans sel, avec une concentration de 30 à 35 %. Puisqu'il n'est pas nécessaire de séparer le sel, l'évaporation facilite grandement la production de soude caustique commerciale à 50 % avec un investissement et un coût énergétique inférieurs. Étant donné que la concentration de soude caustique dans le procédé à membrane est beaucoup plus élevée, du nickel coûteux est utilisé comme cathode.
Riz. 5.3. Schéma d'un électrolyseur au mercure
La réaction de décomposition totale du sel commun dans les électrolyseurs au mercure est la même que dans les cellules à diaphragme :
NaCl + H2O => NaOH + 1/2Cl2 + 1/2H2
Cependant, il se déroule ici en deux étapes, chacune dans un appareillage distinct : un électrolyseur et un décomposeur. Ils sont structurellement interconnectés et sont appelés un bain électrolytique, et parfois un électrolyseur au mercure.
Lors de la première étape du processus - dans l'électrolyseur - la décomposition électrolytique du sel de table a lieu (sa solution saturée est introduite dans l'électrolyseur) avec la production de chlore à l'anode et d'amalgame de sodium à la cathode de mercure, selon le réaction suivante :
NaCl + nHg => l/2Cl2 + NaHgn
Dans le décomposeur, la deuxième étape du processus a lieu, dans laquelle, sous l'action de l'eau, l'amalgame de sodium passe en hydroxyde de sodium et en mercure :
NaHgn + H2O => NaOH + 1/2H2 + nHg
De tout le sel fourni à l'électrolyseur avec de la saumure, seuls 15 à 20% de la quantité fournie entrent dans la réaction (2), et le reste du sel, avec l'eau, quitte l'électrolyseur sous la forme d'un chloranolyte - une solution de sel de table dans une eau contenant 250-270 kg/m3 de NaCl saturée en chlore. L'« amalgame fort » sortant de l'électrolyseur et l'eau sont amenés au décomposeur.
L'électrolyseur dans toutes les conceptions disponibles est réalisé sous la forme d'une auge en acier longue et relativement étroite, légèrement inclinée, au fond de laquelle une fine couche d'amalgame, qui est la cathode, s'écoule par gravité et l'anolyte sur le dessus. La saumure et l'amalgame faible sont alimentés depuis le bord supérieur surélevé de la cellule à travers la "poche d'entrée".
L'amalgame solide s'écoule de l'extrémité inférieure de la cellule à travers la "poche de sortie". Le chlore et le chloranolyte sortent conjointement par un tuyau de dérivation, également situé à l'extrémité inférieure de la cellule. Les anodes sont suspendues au-dessus de l'ensemble du miroir de flux d'amalgame ou de la cathode à une distance de 3 à 5 mm de la cathode. Le haut de la cellule est recouvert d'un couvercle.
Deux types de décomposeurs sont courants : horizontaux et verticaux. Les premiers sont réalisés sous la forme d'une goulotte inclinée en acier de même longueur que la cellule d'électrolyse. Un flux d'amalgame coule au fond du décomposeur, qui est installé avec une légère inclinaison. Un décomposeur en graphite est plongé dans ce flux. L'eau se déplace dans la direction opposée. À la suite de la décomposition de l'amalgame, l'eau est saturée de caustique. La solution caustique, avec l'hydrogène, sort du décomposeur par un tuyau de dérivation au fond, et l'amalgame pauvre ou le mercure est pompé dans la poche de la cellule.
En plus de l'électrolyseur, du décomposeur, des poches et des canalisations de trop-plein, l'ensemble du bain d'électrolyse comprend une pompe à mercure. Deux types de pompes sont utilisés. Dans les cas où les bains sont équipés d'un décomposeur vertical ou lorsque le décomposeur est installé sous la cellule d'électrolyse, on utilise des pompes centrifuges submersibles de type classique, descendues dans le décomposeur. Dans les bains où le décomposeur est installé à côté de l'électrolyseur, l'amalgame est pompé par une pompe rotative à cône de type original.
Toutes les parties en acier de l'électrolyseur qui entrent en contact avec le chlore ou le chloranolyte sont protégées par un revêtement en caoutchouc vulcanisé de qualité spéciale (gommage). La couche protectrice de caoutchouc n'est pas absolument résistante. Avec le temps, il se chlore, devient cassant et se fissure sous l'action de la température. Périodiquement, la couche protectrice est renouvelée. Toutes les autres parties du bain d'électrolyse : décomposeur, pompe, trop-plein - sont en acier non protégé, car ni l'hydrogène ni une solution caustique ne le corrodent.
Actuellement, les anodes en graphite sont les plus courantes dans une cellule à mercure. Cependant, ils sont remplacés par ORTA.
6.Sécurité dans la production de chlore
et protection de l'environnement
Le danger pour le personnel dans la production de chlore est déterminé par la forte toxicité du chlore et du mercure, la possibilité de formation de mélanges gazeux explosifs de chlore et d'hydrogène, d'hydrogène et d'air dans l'équipement, ainsi que des solutions de trichlorure d'azote dans un liquide chlore, l'utilisation dans la production d'électrolyseurs - appareils qui sont sous un potentiel électrique accru par rapport à la terre, les propriétés de l'alcali caustique produit dans cette production.
L'inhalation d'air contenant 0,1 mg/l de chlore pendant 30 à 60 minutes met la vie en danger. L'inhalation d'air contenant plus de 0,001 mg/l de chlore irrite les voies respiratoires. La concentration maximale admissible (MAC) de chlore dans l'air des établissements: moyenne quotidienne de 0,03 mg/m3, maximale ponctuelle de 0,1 mg/m3, dans l'air de la zone de travail des locaux industriels est de 1 mg/m3, la le seuil de perception des odeurs est de 2 mg/m3. À une concentration de 3-6 mg/m3, une odeur distincte est ressentie, une irritation (rougeur) des yeux et des muqueuses du nez se produit, à 15 mg/m3 - irritation du nasopharynx, à 90 mg/m3 - intense crises de toux. L'exposition à 120 - 180 mg/m3 pendant 30 à 60 minutes met la vie en danger, à 300 mg/m3 une issue fatale est possible, une concentration de 2500 mg/m3 entraîne la mort en 5 minutes, à une concentration de 3000 mg/m3 m3 une issue fatale survient après plusieurs respirations. La concentration maximale autorisée de chlore pour le filtrage des masques à gaz industriels et civils est de 2500 mg/m3.
La présence de chlore dans l'air est déterminée par des appareils de reconnaissance chimique : VPKhR, PPKhR, PKhR-MV utilisant des tubes indicateurs IT-44 (couleur rose, seuil de sensibilité 5 mg/m3), IT-45 (couleur orange), aspirateurs AM- 5, AM-0055, AM-0059, NP-3M avec tubes indicateurs pour le chlore, analyseur de gaz universel UG-2 avec une plage de mesure de 0-80 mg/m3, détecteur de gaz "Kolion-701" dans la plage de 0- 20 mg/m3. En espace ouvert - avec les appareils SIP "KORSAR-X". À l'intérieur - avec des appareils SIP "VEGA-M". Pour se protéger contre le chlore en cas de dysfonctionnements ou d'urgences, toutes les personnes présentes dans les ateliers doivent posséder et utiliser en temps opportun des masques à gaz de grades « V » ou « BKF » (sauf pour les ateliers d'électrolyse au mercure), ainsi que des vêtements de protection : tissu ou combinaisons caoutchoutées, bottes et mitaines en caoutchouc. Les boîtes de masques à gaz contre le chlore doivent être peintes en jaune.
Le mercure est plus toxique que le chlore. La concentration maximale admissible de ses vapeurs dans l'air est de 0,00001 mg/l. Il affecte le corps humain lorsqu'il est inhalé et lorsqu'il entre en contact avec la peau, ainsi qu'en contact avec des objets amalgamés. Ses vapeurs et éclaboussures sont adsorbées (absorbées) par les vêtements, la peau, les dents. Dans le même temps, le mercure s'évapore facilement à une température ; disponible dans l'atelier d'électrolyse, et la concentration de ses vapeurs dans l'air est bien supérieure au maximum autorisé. Par conséquent, les ateliers d'électrolyse à cathode liquide sont équipés d'une ventilation puissante qui, lorsqu'elle fonctionnement normal fournit un niveau acceptable de concentration de vapeur de mercure dans l'atmosphère de l'atelier. Cependant, cela ne suffit pas pour un fonctionnement sûr. Il faut aussi respecter la discipline dite du mercure : suivre les règles de manipulation du mercure. Après eux, avant de commencer le travail, le personnel passe par la salle d'inspection sanitaire, dans la section propre de laquelle il laisse ses vêtements de maison et enfile du linge fraîchement lavé, qui est un vêtement de travail. À la fin du quart de travail, les combinaisons et le linge sale sont laissés dans la section sale du poste de contrôle sanitaire, tandis que les travailleurs prennent une douche, se brossent les dents et enfilent des articles ménagers dans la section propre du poste de contrôle sanitaire.
Dans les ateliers qui travaillent avec du chlore et du mercure, vous devez utiliser un masque à gaz de marque G (la boîte du masque à gaz est peinte en noir et jaune) et des gants en caoutchouc., Les règles de "discipline du mercure" prévoient que le travail avec du mercure et des surfaces amalgamées ne doit sous une couche d'eau; le mercure renversé doit être immédiatement évacué dans le drain, où se trouvent des pièges à mercure.
Les émissions de chlore et de vapeur de mercure dans l'atmosphère, les rejets de sels de mercure et de gouttelettes de mercure, les composés contenant du chlore actif dans les eaux usées et l'empoisonnement des sols par les boues de mercure constituent un danger pour l'environnement. Le chlore pénètre dans l'atmosphère lors d'accidents, avec les émissions de ventilation et les gaz d'échappement de divers appareils. La vapeur de mercure est réalisée avec l'air des systèmes de ventilation. La norme de teneur en chlore dans l'air lorsqu'il est rejeté dans l'atmosphère est de 0,03 mg/m3. Cette concentration peut être atteinte si un lavage alcalin multi-étapes des gaz de dégagement est utilisé. La norme de teneur en mercure dans l'air lorsqu'elle est émise dans l'atmosphère est de 0,0003 mg/m3, et dans les eaux usées lorsqu'elle est rejetée dans les masses d'eau est de 4 mg/m3.
Neutralisez le chlore avec les solutions suivantes :
lait de chaux, pour lequel 1 partie en poids de chaux éteinte est versée dans 3 parties d'eau, bien mélangée, puis le mortier de chaux est égoutté par le haut (par exemple, 10 kg de chaux éteinte + 30 litres d'eau);
Solution aqueuse de carbonate de soude à 5 %, pour laquelle 2 parties en poids de carbonate de soude sont dissoutes sous agitation avec 18 parties d'eau (par exemple, 5 kg de carbonate de soude + 95 litres d'eau) ;
Solution aqueuse de soude caustique à 5 %, pour laquelle 2 parties en poids de soude caustique sont dissoutes sous agitation avec 18 parties d'eau (par exemple, 5 kg de soude caustique + 95 litres d'eau).
En cas de fuite de chlore gazeux, de l'eau est pulvérisée pour éteindre les vapeurs. Le taux de consommation d'eau n'est pas standardisé.
En cas de déversement de chlore liquide, le site du déversement est clôturé par un rempart en terre, rempli de lait de chaux, d'une solution de carbonate de soude, de soude caustique ou d'eau. Pour neutraliser 1 tonne de chlore liquide, 0,6 à 0,9 tonne d'eau ou 0,5 à 0,8 tonne de solutions sont nécessaires. Pour neutraliser 1 tonne de chlore liquide, 22 à 25 tonnes de solutions ou 333 à 500 tonnes d'eau sont nécessaires.
Pour pulvériser de l'eau ou des solutions, des camions d'arrosage et de pompiers, des stations d'auto-embouteillage (AC, PM-130, ARS-14, ARS-15), ainsi que des bouches d'incendie et des systèmes spéciaux disponibles dans les installations chimiquement dangereuses sont utilisés.
Conclusion
Les volumes de chlore produits par les méthodes de laboratoire étant négligeables par rapport à la demande sans cesse croissante de ce produit, les traverser analyse comparative n'a pas de sens.
Parmi les méthodes de production électrochimique, la plus simple et la plus pratique est l'électrolyse avec une cathode liquide (mercure), mais cette méthode n'est pas sans inconvénients. Il cause des dommages environnementaux importants par évaporation et fuite de mercure métallique et de chlore gazeux.
Les électrolyseurs à cathode solide éliminent le risque de pollution de l'environnement par le mercure. Lors du choix entre les électrolyseurs à membrane et à membrane pour les nouvelles installations de production, ces derniers sont préférés car ils sont plus économiques et fournissent un produit final de meilleure qualité.
Bibliographie
1.Zaretsky S. A., Suchkov V. N., Zhivotinsky P. B. Technologie électrochimique des substances inorganiques et des sources de courant chimiques: un manuel pour les étudiants des écoles techniques. M.. : Plus haut. École, 1980. 423 p.
2.Mazanko A. F., Kamaryan G. M., Romashin O. P. Électrolyse à membrane industrielle. M. : maison d'édition "Chimie", 1989. 240 p.
.Pozin M.E. Technologie des sels minéraux (engrais, pesticides, sels industriels, oxydes et acides), partie 1, éd. 4e, rév. L., Maison d'édition "Chimie", 1974. 792 p.
.Fioshin M. Ya., Pavlov VN Électrolyse en chimie inorganique. M. : maison d'édition "Nauka", 1976. 106 p.
.Yakimenko L. M. Production de chlore, de soude caustique et de produits chlorés inorganiques. M. : maison d'édition "Chimie", 1974. 600 p.
Sources Internet
6.Règles de sécurité pour la production, le stockage, le transport et l'utilisation du chlore // URL : #"justify">7. Substances dangereuses // URL : #"justify">. Chlore : application // URL : #"justifier">.
Nous en savons beaucoup sur les concombres. On les mange souvent, on les ajoute aux salades, on les conserve et on les fait mariner, on fait des masques rafraîchissants pour le visage et sous les yeux. Ce légume vert est polyvalent. Il convient non seulement pour manger, mais aussi pour les procédures médicales, en raison de sa composition.
La composition du concombre : vitamines, oligo-éléments, calories
La teneur en calories d'un concombre ne dépasse pas 15 kcal pour 100 g, ce qui s'explique par le fait qu'il est composé à 95 % d'eau. Pour ceux qui sont au régime, ce légume est tout simplement irremplaçable. Il ne contient pratiquement pas de glucides, de graisses et de protéines.
Le concombre contient des enzymes. Ils facilitent la digestion des aliments d'origine animale, c'est pourquoi les concombres sont souvent associés à des plats de viande.
Parmi les oligo-éléments de ce légume, le plus potassium. Un peu moins contient du phosphore, du calcium, du magnésium et du fer.
Non dépourvu de concombre et de vitamines. Il est saturé de vitamines C, A, B1 et B2, R.
Les bienfaits du concombre
Les bienfaits du concombre sont directement proportionnels à sa composition. Les vitamines et les composants minéraux affectent favorablement le fonctionnement de nombreux organes et systèmes : le foie, le cœur et les vaisseaux sanguins, les reins, le tractus gastro-intestinal et bien d'autres. autres
Concombres frais
Dans des concombres frais haute teneur en fibres. Il aide à améliorer la motilité intestinale et à accélérer la digestion des aliments. Ainsi, les toxines dans le corps ne s'attardent pas, ce qui est important en cas de constipation constante ou fréquente.
Les fibres résistent à l'accumulation de cholestérol sur les parois des vaisseaux sanguins et à la formation de plaques. Et cela aide à éviter l'athérosclérose et les maladies coronariennes.
Grâce au potassium, l'excès de liquide sera éliminé du corps, ce qui signifie que l'enflure diminuera. Cet oligo-élément a également un effet positif sur l'hypertension artérielle.
Disponibilité iode contribuera à prévenir l'apparition de pathologies thyroïdiennes.

Salé, mariné, mariné
Les concombres marinés contiennent des bactéries bénéfiques pour la microflore intestinale. Ils bloquent le développement des microbes nocifs. La présence d'acide lactique dans ce plat réduit la quantité de graisse dans le sang, ce qui facilite sa circulation dans les vaisseaux. Il aide à réduire l'hypertension artérielle en cas d'hypertension.
Le cornichon au concombre améliore non seulement la flore intestinale, mais a également un léger effet laxatif.
Les concombres marinés aideront à réveiller votre appétit, il est donc utile de les utiliser pour ceux qui veulent aller mieux. Ils améliorent le fonctionnement du système digestif.
Les concombres marinés ont les mêmes propriétés que les concombres marinés et salés. Mais, en plus de cela, ils renforcent la fonction protectrice du système immunitaire.

Jus
La composition du jus de concombre ressemble à l'eau de sources respectueuses de l'environnement, c'est pourquoi il est si populaire.
Il régule l'équilibre acido-basique de l'organisme. L'excès de sodium et de liquide est éliminé.
Note! Si le jus de concombre est mélangé avec du jus de carotte, ce mélange est un excellent remède contre les maladies rhumatismales.
La laitue, les épinards, la carotte et le jus de concombre combinés accéléreront la croissance et la force des cheveux.
L'utilisation de précieux jus de concombre non seulement abaisse la tension artérielle, mais contribue également à la prévention du cancer.
S'il y a des problèmes avec les dents ou les gencives, un rinçage avec du jus de concombre aidera.
Le jus traite également la toux sèche. Pour ce faire, ajoutez un peu de miel au jus et prenez-le en interne.
Le jus de concombre contient beaucoup d'iode, qui est facilement absorbé. Le jus de concombre aide à résoudre les problèmes de thyroïde.

Salade de concombre
Le concombre est un invité fréquent sur la table, surtout pendant la saison de maturation. Nous ne nous contentons pas de le manger, mais de l'ajouter à une variété de salades. D'un goût si délicat et incroyable légume parfumé n'importe quel plat gagnera.
En ajoutant des concombres aux salades, vous contribuez meilleure assimilation substances utiles non seulement de ce légume, mais d'autres composants du plat.
Si la salade de concombre est consommée avec de la viande ou d'autres aliments riches en calories, alors il sera digéré beaucoup plus rapidement et plus facilement.

Quels sont les avantages des concombres ?
Les concombres sont utiles pour presque tout le monde sans restriction. Mais il y a des caractéristiques qui sont importantes pour chaque sexe, âge ou période.
Pour le corps d'une femme
Les concombres pour une femme sont un moyen de perdre du poids et d'avoir toujours l'air jeune et frais.
Ce légume est utilisé lors d'un régime pour débarrasser le corps de l'excès d'eau et éliminer les dépôts de graisse avec lui.
Les masques, lotions et autres produits de soins de la peau ne laisseront aucune femme indifférente. Afin de toujours avoir l'air parfait, vous n'avez pas besoin de courir au magasin pour des cosmétiques coûteux, car il y a quelques concombres frais dans votre réfrigérateur.
Des masques réguliers, des frottements, des compresses de concombre aideront à rendre la peau souple, jeune et respirante.
Pour le corps d'un homme
L'effet bénéfique des concombres sur le corps masculin est similaire à l'effet d'un légume sur le corps féminin.
Un autre avantage de manger des concombres frais est que la consommation régulière de jus de concombre aide à éviter la calvitie.

Pour les enfants
Pour les enfants, le concombre est important car la consommation régulière de concombre permet d'éviter le développement d'une anémie due à une carence en silicium.
Il contient du potassium, et il est simplement nécessaire pour une forte système nerveux et des miettes de psyché équilibrées.
Note! Le concombre régule les processus métaboliques dans les intestins, rend le système immunitaire plus résistant et renforce les tissus musculaires et osseux de l'enfant.
La présence d'iode protège la glande thyroïde et prévient toutes les conséquences d'un manque de cet élément.
Pour la première fois, les pédiatres recommandent de donner à un enfant un concombre à essayer au plus tôt un an, car l'estomac n'est pas encore capable de faire face à la digestion d'un légume.

Pour les femmes enceintes
Pour une femme enceinte, il est extrêmement important que l'équilibre eau-sel soit normal. Le concombre, qui contient du potassium, l'aidera. Il aide à éliminer l'excès d'eau des tissus et à ne pas s'accumuler à nouveau en quantités excessives.
Pendant la grossesse, il y a des problèmes avec les selles. En conséquence, la femme est préoccupée par la constipation. Vous pouvez mettre en place un processus naturel à l'aide d'un concombre frais, puisqu'il agit comme laxatif doux.
Le concombre nettoie également le corps des substances nocives, ce qui est important pendant la grossesse.

Pour le visage
Les avantages du concombre sont évidents non seulement lorsqu'il est consommé en interne, mais aussi lorsqu'il est utilisé en externe. En raison de sa capacité à démarrer le processus de régénération des cellules cutanées, ce légume est inclus dans une grande variété de produits cosmétiques pour les soins de la peau du corps de la tête aux pieds.
À la maison, il est très facile de réaliser une procédure cosmétique de rajeunissement du visage. Il suffira que vous essuyiez votre visage avec un cercle de concombre ou que vous les mettiez sur les zones à problèmes.
À l'aide de masques aussi simples, vous pouvez blanchir votre peau, rendre la pigmentation et les taches de rousseur moins visibles.
Le concombre est idéal pour les épidermes de type gras en tant que nettoyant. Il va hydrater et rajeunir la peau sèche.
De plus, les lotions au concombre aideront à se débarrasser de l'enflure, des cernes bleus sous les yeux et d'une sensation de fatigue.
Contre-indications et dommages à la santé du concombre
En raison de son fort effet diurétique, les concombres frais ne doivent pas être consommés par les personnes souffrant de calculs rénaux, d'ulcères d'estomac et d'entérocolite.
Ceci est un proche parent de la courgette, de la pastèque et du melon, appartient à la famille citrouille. Son nom scientifique « cucumis sativus" est traduit du latin par " graine de concombre". Selon les informations des ouvrages de référence botaniques, le fruit de cette plante est classé comme une baie. Certes, avec une mise en garde - aux fausses baies. En termes de caractéristiques culinaires et gustatives, le concombre est toujours considéré comme une culture légumière, qui, soit dit en passant, se classe au 4e rang mondial en termes de culture parmi les légumes.
Histoire
Le concombre est considéré comme l'un des plus anciens représentants cultures maraîchères qui est apparu il y a quatre millénaires. Bien qu'il existe des hypothèses audacieuses selon lesquelles le concombre a déjà plus de 6 000 ans. Il n'y a pas d'informations sans équivoque sur la patrie de ce légume, mais il s'agissait très probablement des régions tropicales et subtropicales de l'Inde et de la Chine anciennes. Nous pouvons certainement dire qu'au début, le concombre poussait à l'état sauvage. Ce n'est qu'au IIe millénaire av. les anciens indiens le cultivaient et l'introduisaient peu à peu dans leur alimentation.
Grâce à l'augmentation des volumes de culture et aux relations commerciales établies, le concombre part à la conquête du monde depuis l'Inde et la Chine. C'est ainsi qu'il est arrivé en Egypte La Grèce ancienne et bien plus tard à l'Empire romain. Il y a des raisons de croire que c'est du nom grec de ce légume vert "ἄγουρος" (revient à "ἄωρος" - pas mûr) que vient le mot "concombre". D'ailleurs, le nom anglais "cucumber" vient de mot français"concombre", qui, à son tour, a été emprunté à la langue latine ("cucumis").
Que dans les temps anciens, le concombre était une partie importante de le régime alimentaire des gens, témoignent de ses images sur les fresques des temples grecs et égyptiens. Outre, caractéristiques avantageuses Ce légume croquant a été décrit par Aristote et Hippocrate. Dans la Rome antique, les concombres étaient consommés à la fois par les classes d'élite et les classes inférieures. Et l'empereur Tibère ordonna de lui servir un concombre chaque jour de l'année. Ensuite, les concombres ont commencé à être cultivés dans des caisses sur roues afin qu'ils puissent être déplacés en fonction de la lumière du soleil. On pense que les premières recettes de salage sont apparues à la même époque.
Dès l'Empire romain, le concombre s'est répandu dans toute l'Europe (en France - à partir du IXe siècle, en Angleterre - à partir du XIVe siècle). Au XVe siècle, grâce à Christophe Colomb, le concombre atteignit les rives du Nouveau Monde, où il gagna également rapidement en popularité parmi les habitants. Cependant, au début du XVIIe siècle. en Amérique, il y avait des informations sur ce qu'il fallait manger légumes crus et les fruits sont dangereux pour la santé, de sorte que le concombre a perdu sa position pendant un certain temps et a reçu un surnom moqueur "cowcumber" (eng. concombre pour nourrir les vaches). Seulement une centaine d'années plus tard, le légume vert est revenu sur les tables des Américains.
On ne sait pas avec certitude quand et comment le concombre est arrivé chez Rus'. Il existe une théorie selon laquelle ce légume nous est venu d'Europe après le baptême de Rus'. Bien que certains scientifiques pensent que nos marchands ont acheté des concombres en Asie de l'Est dès le IXe siècle. En tout cas, l'une des premières références écrites à ce légume remonte à la première moitié du XVIIe siècle. (Notes du voyageur allemand Elschleger). Au même moment, Pierre I a publié un décret sur la culture de cette culture dans le jardin royal. C'est alors que les premières serres ont commencé à apparaître.
Variétés
Malgré le fait que les concombres ont besoin d'un ensemble de certaines conditions pour mûrir normalement, grâce aux efforts des sélectionneurs, ils sont maintenant cultivés dans différentes zones climatiques et sur des sols de composition différente. L'essentiel est de choisir la bonne variété.
Selon le temps de maturation, les concombres sont divisés en maturité précoce, maturation jusqu'à 45 jours (cupidon, artiste, Hector, Masha), mi-maturation, maturation jusqu'à 50 jours (concurrent, non femelle, table, mère en -loi), et maturation tardive, maturation de plus de 50 jours (phoenix , Aquarius, Alice). Il existe également une division des variétés de concombres en fonction de leur utilisation prévue : pour la consommation fraîche, pour le marinage ou la conservation, et universelle, adaptée aux deux fins.
Fait intéressant, le légume vert oblong que nous connaissons a de nombreux parents exotiques qui sont considérés comme ses variétés. Par exemple, le concombre africain Kiwano a une peau jaune avec des épines et une chair verte juteuse, rappelant légèrement notre concombre traditionnel. L'œuf de dragon se distingue par sa douceur et la couleur claire de sa coquille, sa forme arrondie et son goût sucré. Et les concombres Red Hmong deviennent rouges à maturité et ont un peu le goût du melon.
Un concombre appelé Gak ou Spring Bitter a une peau rouge orangé et une chair rouge tendre. Il contient une grande quantité d'antioxydants, ce qui le rend très utile, cependant, il ne tolère pas bien le transport, il ne peut donc être trouvé que dans les endroits où il est cultivé. Il existe également des concombres sauvages décoratifs, également appelés hérissons. Ils tressent des haies et des clôtures, et leurs fruits sont recouverts d'aiguilles. La particularité de ces concombres est qu'au moment de la maturation, la peau du fruit s'étire au maximum et éclate. En même temps, des graines et un peu de mucus sortent de deux petits trous sous pression.

Fonctionnalités croissantes
Le concombre est une plante grimpante avec une tige rampante qui peut atteindre deux mètres ou plus de long. Les pousses latérales et les vrilles partent de la tige principale, à l'aide desquelles la plante peut être fixée sur des supports, en prenant une position verticale. Grâce à cela, il est possible de faire pousser des concombres sur des treillis (cette méthode est généralement utilisée dans les serres et sur les balcons), bien que si l'espace dans le jardin / lit le permet, la tige est autorisée à se répandre sur le sol. La longueur et le degré de ramification dépendent de la variété.
Pendant la floraison, des fleurs jaunes mâles (avec étamines) et femelles (avec pistils) se forment sur la plante. Les fleurs femelles diffèrent par le fait qu'il y a un ovaire sous elles et qu'elles sont situées seules ou en 2-3 pièces sur les pousses latérales, tandis que les fleurs mâles (fleurs vides) forment des inflorescences de 5-7 pièces principalement sur la tige principale. La fécondation se produit principalement lors de l'ouverture des fleurs (1-2 jours). Le pollen est transporté par les abeilles et autres insectes, qui sont attirés par la couleur jaune vif et la présence de nectar.
Par temps froid ou dans des conditions de culture en serre, le processus de pollinisation devient plus compliqué - il se fait manuellement, les sélectionneurs ont donc commencé à sélectionner des hybrides. Ils sont obtenus par pollinisation artificielle de fleurs de différentes variétés. Dans son nom, l'hybride doit avoir un symbole distinctif - F (filli - enfants italiens) et un numéro indiquant le numéro de génération. De plus, à notre époque, des concombres sont apparus qui ne nécessitent aucune pollinisation - parthénocarpiques, ainsi qu'autopollinisés - leurs fleurs ont à la fois une étamine et un pistil.
Les concombres commencent généralement à être récoltés lorsque les fruits ne sont pas encore biologiquement mûrs, c'est pourquoi ils sont appelés verts. Faire mûrir et acquérir une teinte jaune-brun n'est donné qu'aux concombres dont le matériel de semence est prélevé pour la plantation ou pour la sélection.
La plantation de concombres peut être réalisée à la fois avec des semis et des graines. Habituellement, les semis fournissent une récolte plus précoce, mais nécessitent également plus d'attention. Après la plantation sur les plates-bandes, les jeunes plantes doivent être enveloppées en cas de baisse de température. En général, le concombre est une plante qui aime la chaleur, l'humidité et la lumière et qui ne tolère pas les courants d'air (note à ceux qui cultivent des légumes à la maison sur les rebords de fenêtres). Il est recommandé de planter les concombres à une distance d'au moins 20 cm les uns des autres à une profondeur de 2 à 2,5 cm dans la deuxième ou la troisième décade de mai (à une température de 18 à 25 ° C).
Parmi les principaux ravageurs du concombre, un tétranyque se distingue, qui se dépose sur la face inférieure des feuilles et se nourrit de leur jus, ce qui entraîne l'apparition de points blancs sur les feuilles, puis, tressées de toiles d'araignées, elles se dessèchent. Les concombres ont également peur des pucerons du melon, qui vivent sur toutes les parties de la plante et aspirent son jus. Après cela, les feuilles commencent à jaunir et à mourir. Le moustique du concombre est également dangereux, dont la larve translucide à tête noire est introduite dans la tige et la racine d'une plante affaiblie, après quoi elle meurt.
Les produits chimiques sont couramment utilisés pour lutter contre les ravageurs. Cependant, afin d'empêcher les insectes nuisibles de pénétrer dans la plante, un désherbage régulier doit être effectué pour éliminer les mauvaises herbes.

Comment choisir
DANS heure d'été ans, il vaut mieux acheter les concombres le matin, avant qu'ils ne perdent leur fraîcheur, allongés au soleil. Si les concombres sont déjà un peu fanés, vous pouvez les "raviver" en les laissant dans de l'eau froide pendant 2-3 heures. Au fait, tremper dans eau froide(environ 30 minutes) favorise l'élimination des nitrates. Pour accentuer l'effet, mettez les concombres dans un bol transparent et laissez dans un endroit lumineux ( rayons de soleil contribuer à l'accélération de l'élimination des substances nocives).
Acheter des concombres doit être dense, sans dommages visibles ni taches jaunes. Lorsque vous achetez des concombres hors saison, vous devez faire attention à la brillance non naturelle. légumes importés souvent, lors du transport, ils sont recouverts d'une fine couche de paraffine pour leur meilleure conservation. Dans ce cas, avant de manger le légume, il faut couper la peau. Et s'il n'y a pas du tout de graines à l'intérieur, il est préférable de jeter un tel concombre, en raison de la présence de un grand nombre substances dangereuses.
En général, le choix des concombres dépend de votre objectif. Presque tous les concombres peuvent être utilisés pour la salade, mais les fruits lisses spécialement sélectionnés avec une peau épaisse, d'environ 13 cm de long, sont considérés comme les plus appropriés.Ils ont un arôme riche. Vous pouvez prendre des concombres avec des pointes blanches.
Les meilleurs concombres marinés sont obtenus à partir de fruits de 9 à 12 cm de long avec des pointes sombres (ils s'enlèvent facilement lorsqu'ils sont lavés, ce qui permet à la saumure de tremper intensément le concombre). Pour le marinage, il est recommandé de prendre des concombres jusqu'à 9 cm (cornichons à fruits courts) de couleur vert foncé avec des pointes claires ou des rayures claires sur le côté. Les fruits à épines foncées conviennent également.
Comment stocker
Quant au stockage des concombres frais, ils peuvent généralement être conservés au réfrigérateur pendant environ 3 à 5 jours. Il est important de les alimenter en air et de ne pas les entreposer à proximité fruits mûrs et légumes. Pour augmenter la durée de conservation jusqu'à 10 jours, ils sont placés dans sac plastique, recouvert de gaze humide sur le dessus et envoyé au réfrigérateur. Les concombres enveloppés dans du papier absorbant et placés dans un sac ouvert peuvent être conservés au réfrigérateur pendant environ deux semaines. Pour que les légumes restent frais pendant 3 à 4 semaines, ils sont plongés dans des queues dans de l'eau froide de 1 à 2 cm et mis au réfrigérateur. L'eau du réservoir doit être changée tous les jours.
Propriétés utiles des concombres
Composition chimique et présence de nutriments
| Substances principales (mg/100 g) : | Frais avec la peau | Frais sans peau | mariné |
| Eau | 95,23 | 96,73 | 94,08 |
| Écureuils | 0,65 | 0,59 | 0,33 |
| Graisses | 0,11 | 0,16 | 0,20 |
| Les glucides | 3,63 | 2,16 | 2,26 |
| Sucre | 1,67 | 1,38 | 1,06 |
| Fibre alimentaire | 0,5 | 0,7 | 1,2 |
| Calories (Kcal) | 15 | 10 | 11 |
| Minéraux | |||
| Potassium | 147 | 136 | 23 |
| Phosphore | 24 | 21 | 14 |
| Calcium | 16 | 14 | - |
| Magnésium | 13 | 12 | 4 |
| Sodium | 2 | 2 | 1208 |
| Fer | 0,28 | 0,22 | 0,40 |
| Zinc | 0,20 | 0,17 | 0,02 |
| vitamines | |||
| Vitamine C | 2,8 | 3,2 | 1 |
| Vitamine PP | 0,098 | 0,037 | - |
| Vitamine B6 | 0,040 | 0,051 | 0,009 |
| Vitamine B2 | 0,033 | 0,025 | 0,010 |
| Vitamine E | 0,030 | 0,03 | 0,09 |
| Vitamine B1 | 0,027 | 0,031 | - |
| Vitamine K | 0,016 | 0,007 | 0,047 |
| Vitamine B9 | 0,007 | 0,014 | 0,001 |
| Vitamine A | 0,005 | 0,004 | 0,01 |
Sur la base des tableaux ci-dessus, nous pouvons conclure qu'il est plus utile de manger des concombres avec la peau, qui contient de nombreuses substances utiles. Cependant, pelés et marinés, les concombres conservent certaines propriétés utiles. Certes, il convient de garder à l'esprit que sous une forme salée ou marinée, le niveau de sodium qu'ils contiennent augmente fortement, ce qui peut nuire à la santé des personnes souffrant d'insuffisance rénale. Dans le même temps, la proportion de vitamines diminue, le taux de potassium, de magnésium, de zinc et de calcium diminue. Et trop de sel peut entraîner la destruction de l'émail des dents, la rétention d'eau dans le corps et la perturbation du tube digestif.

Propriétés médicales
Le concombre est inférieur à de nombreux légumes en termes de teneur en vitamines, car il se compose presque entièrement d'eau. Cependant, l'eau de concombre est riche des sels minéraux et des substances biologiquement actives. Par exemple, les fruits du concombre contiennent des enzymes qui favorisent l'absorption des protéines et des vitamines B, ainsi que le maintien d'une réaction sanguine normale. De plus, les concombres contiennent une enzyme analogue à l'insuline, ce qui en fait un aliment de base important dans l'alimentation des diabétiques.
De plus, l'eau de concombre aide à nettoyer le corps en dissolvant les toxines. Autrement dit, le concombre ne doit pas être utilisé comme aliment autonome, mais il joue un rôle important dans l'absorption d'autres aliments, comme la viande. En raison de leur faible teneur en calories, les concombres sont recommandés pour les personnes sujettes à l'obésité.
Bien qu'en petites quantités, les concombres contiennent du phosphore, du potassium, du calcium, du soufre, du magnésium, du sodium, du fer, du zinc et de l'iode (sous une forme facilement digestible). Pour cette raison, ils ont des propriétés cholérétiques et diurétiques, aident à améliorer l'activité du système cardiovasculaire et sont recommandés pour les personnes souffrant de maladies thyroïdiennes. De plus, un tel ensemble d'oligo-éléments améliore l'état des ongles, des cheveux, des dents humaines et réduit l'acidité du suc gastrique. Soit dit en passant, les fibres, qui font partie des concombres, ont le meilleur effet sur le processus de digestion. Une lumière effet laxatif aide à se débarrasser de la constipation.
Quant aux vitamines, les concombres vantent la présence de carotène, thiamine, riboflavine, folates, etc. dans leur composition. Ces derniers participent activement à la régulation du niveau d'homocystéine, un acide aminé qui se forme dans l'organisme au cours du métabolisme, et augmente le risque de lésions vasculaires athérosclérotiques et de thrombose.
Un autre composant utile du concombre est le phytostérol (phytostérol) - un alcool stéroïdien qui ne se dissout pas dans l'eau. En fait, nous parlons d'une contrepartie végétale du cholestérol. Son avantage est qu'il est sans danger pour l'homme et ne provoque pas le développement de l'athérosclérose. Une fois dans le corps, le phytostérol inhibe jusqu'à 10% de l'absorption du cholestérol et pénètre dans le sang sans causer de dommages à l'organisme.
Utilisation en médecine
En médecine traditionnelle, le concombre, malgré la présence d'éléments et de propriétés utiles, n'est pas utilisé et n'est pas considéré comme une plante de pharmacopée. Néanmoins, fruits verts déjà pendant longtemps utilisé activement et avec succès dans la médecine traditionnelle et la cosmétologie.
D'abord le plus simple application populaire concombre - externe. Lors de petites brûlures, écorchures ou blessures, il est recommandé d'attacher un concombre coupé à la zone endommagée ou de lubrifier cet endroit avec du jus de concombre frais. Cela garantit un puissant effet antimicrobien (même en cas de suppuration). Deuxièmement, diverses décoctions, des infusions sont préparées à base de concombre, des compresses en sont faites. De plus, non seulement les fruits eux-mêmes et le jus sont mis en circulation, mais aussi les fleurs, les feuilles et les cils de la plante (généralement sous forme séchée).

Décoctions et infusions
Une décoction de concombres frais peut aider à se débarrasser de l'œdème apparu en raison de pathologies cardiaques ou de varices. Pour ce faire, hachez finement 100 g de concombre lavé, versez dessus 200 ml d'eau bouillante et faites cuire à feu doux pendant 5 minutes. Une demi-tasse de cette décoction doit être bue avant les repas trois fois par jour pendant 7 à 10 jours.
Breuvages
Le jus de concombre a de nombreuses propriétés utiles, il est donc recommandé de le boire sous sa forme pure. Cependant, en raison de l'effet rafraîchissant du concombre, il est souvent ajouté à diverses boissons estivales. Par exemple, un smoothie citron vert et pastèque (200g de pulpe de pastèque, 1/2 citron vert, 1/2 concombre, un bouquet de menthe et de l'eau) ou un smoothie épinards et céleri (mixer au blender : 100g d'épinards, 1 pomme verte, 1 concombre, 1 branche de céleri, 1 morceau de gingembre, 2 c. jus de citron). L'eau de concombre est également appréciée (1 concombre, 1 bouquet de menthe, un demi-citron, 1 litre d'eau).
Utilisation en cosmétologie
Le concombre est considéré comme un bon produit cosmétique qui a un effet rafraîchissant et rajeunissant sur la peau. Grâce au phytostérol, l'humidité est retenue et il y a un léger effet lifting. Et les sels alcalins nourrissent la peau et ont un effet blanchissant en éliminant la plaque.

Maintenant, il existe une vaste sélection de toutes sortes de masques, lotions, toniques, gels à base de concombre, mais en été, vous pouvez préparer un produit cosmétique à la maison.
Afin de rafraîchir la peau du visage après un surmenage, un manque de sommeil ou un stress, il faut prendre 1 concombre et 1 protéine de poulet. Vous devez râper le concombre sur une râpe fine et prendre 2 cuillères à soupe. bouillie, en les combinant avec du blanc d'œuf fouetté en mousse. Appliquez ensuite le masque sur le visage pendant 15 minutes et rincez à l'eau. Et pour la peau autour des yeux, il est recommandé de mélanger 2 cuillères à soupe. concombre râpé avec du persil haché.
Pour obtenir un effet rajeunissant, vous devez mélanger 1 cuillère à soupe. concombre râpé avec 1 c. argile blanche. Un effet hydratant est donné par un masque préparé à partir de 1 cuillère à soupe. concombre râpé, 1 cuillère à café menthe ciselée et 1 cuil. basilic ciselé.
L'un des premiers pays où le concombre a été cultivé et a commencé à être consommé était la Chine. Il existe une légende selon laquelle ce sont les Chinois qui ont introduit ce légume en Turquie. Entre autres cadeaux, ils ont envoyé au sultan turc Magomed II plusieurs fruits exotiques - des concombres. Le sultan s'est pris d'affection pour ce légume extravagant et il a fait appel à sept des meilleurs gardes de la cour pour le garder. Cependant, un concombre a disparu et tous les gardes ont nié toute implication dans le vol. Alors le sultan enragé décida d'organiser une sorte de fouille, donnant l'ordre de déchirer le ventre de tous les sept.
C'est peut-être pour cette raison que le dicton est apparu dans la langue turque "Prenez soin du concombre avec une hache". Certes, maintenant, de tels mots sont généralement adressés à une personne qui commet une stupidité. En anglais et en russe, les proverbes sur les concombres ont une signification plutôt positive. Alors les anglais disent aussi cool qu'un concombre", qui se traduit littéralement par " calme comme un concombre» et signifie l'équanimité absolue. En Russie, on entend souvent l'expression " être comme un concombre", ce qui signifie être joyeux et bien paraître. Et les Brésiliens utilisent même le mot " chuchuzinho"(Port. Chayote ou concombre mexicain) pour un appel affectueux aux êtres chers.
Au fait, à propos de l'amour. En 2011, une série intitulée Cucumber Love a été tournée en Russie, qui raconte la vie dans le petit village de Gorelkovo, célèbre pour ses champs de concombres. De plus, en 1985, en Union soviétique, basé sur le conte de fées de Galina Lebedeva, le dessin animé "Cucumber Horse" a été créé. Les légumes verts croustillants jouent également un rôle dans l'intrigue dans l'histoire instructive "Concombres" du prosateur pour enfants Nikolai Nosov. Les écrivains Vladimir Klimenko (l'histoire "Mad Cucumbers") et Vsevolod Ivanov (l'histoire "Nezhinsky Cucumbers") ont également abordé le sujet des concombres.

Ce légume vert n'a pas été épargné par les grands peintres. Les natures mortes «Concombres» de Kondrat Maksimov et Mikhail Makhalov (1), ainsi que le tableau «Nature morte aux légumes» d'Ivan Khrutsky, sont devenus célèbres. De plus, les artistes du Moyen Âge ont commencé à représenter des concombres sur leurs toiles. Ainsi, l'Espagnol Luis Mendelez a peint une nature morte "Concombres, tomates et plats". Et l'Italien Giuseppe Arcimboldo a utilisé un concombre pour représenter le nez du personnage dans le tableau "Summer" (2).
Et Carlo Crivelli s'est distingué en inscrivant des concombres dans les sujets chrétiens de ses tableaux. Jusqu'à présent, les scientifiques ne s'accordaient pas sur la symbolique des concombres sur une série de peintures de Crivelli "Vierge à l'Enfant" (3) et "Annonciation". Comme le concombre est souvent situé à côté de la pomme, il est parfois interprété par analogie comme un symbole de tentation et de péché originel. Bien que certains chercheurs pensent que le concombre, au contraire, symbolisait la résurrection et la vitalité.
Apparemment, les habitants modernes de l'île de Fidji croient également à la vitalité que donne le concombre. Ils consomment non seulement des concombres, mais préparent également leurs stocks en cas de mauvaise récolte ou de catastrophe naturelle. En règle générale, les légumes sont enveloppés de feuilles de bananier et enterrés dans le sol. De plus, la taille de l'offre de concombres peut aider un homme à se marier, puisque les parents des filles sont généralement plus disposés à marier leurs filles à des "magnats du concombre".
Soit dit en passant, aux Fidji, ainsi qu'en Asie, non seulement les concombres sont populaires sous la forme dans laquelle nous avons l'habitude de les voir, mais aussi les soi-disant concombres de mer. En fait, nous parlons d'holothuries - des animaux invertébrés tels que les échinodermes. Les espèces consommées sont généralement appelées collectivement "trepangs". Ces fruits de mer orientaux sont considérés comme extrêmement délices sains, ils sont donc souvent pêchés illégalement et vendus sur le marché noir. Là-bas, le prix pour 1 kg de concombres de mer peut atteindre jusqu'à 500 dollars.
Certes, en toute légalité, nos traditionnels légumes verts battent aussi leurs records. Au Royaume-Uni, deux retraités ont cultivé indépendamment des fruits de 1,2 m de long dans leur lit. Cependant, le concombre le plus long est considéré comme un légume qui a mûri dans l'une des serres de Hongrie. Un record de 1,83 m est inscrit dans le livre Guinness des records.
Dans différentes parties du monde, les gens ont immortalisé le concombre en lui érigeant des monuments. Par exemple, il existe un tel monument à Poznan, en Pologne. Toujours à Nizhyn ukrainien, il y a un monument à un concombre non féminin, et à Shklov biélorusse, il y a un concombre en bronze "Napoléon". Ce légume est vénéré en Autriche - à Salzbourg, il y a toute une installation "Concombres". Ils sont également respectés en Russie, car en plus du monument, à Lukhovitsy près de Moscou, il y a tout un musée consacré au concombre.
Mais à Londres, le concombre était à l'honneur en grand. Il n'y a pas de monument ici, mais en 2004, un immeuble de grande hauteur 30 St Mary Axe (Saint Mary Axe 30) est apparu, que les Britanniques eux-mêmes à cause de ressemblance et le rétroéclairage verdâtre s'appelle "The Gherkin" (concombre anglais). Fait intéressant, en fait, la création de ce projet architectural a été inspirée par les créateurs de la bosse.

Propriétés dangereuses des concombres et contre-indications
Concombres - produit diététique, mais même ils peuvent parfois nuire au corps. Il est recommandé de refuser leur utilisation dans de tels cas:
- exacerbation des ulcères d'estomac;
- gastrite aiguë et chronique et entérocolite;
- néphrite et pyélonéphrite aiguës et chroniques, ainsi que hépatite et cholécystite (vous devez éviter de manger des cornichons);
- nourrir le bébé (peut provoquer une indigestion et des coliques chez le bébé).
L'idée fausse selon laquelle les concombres ne sont pas bénéfiques pour l'homme en raison de leur forte teneur en eau devrait être reconsidérée depuis longtemps. Ce légume est produit unique, qui doit être inclus dans le régime alimentaire de tout le monde. Les bienfaits des concombres pour l'homme sont indéniables, et il sera très intéressant de mieux connaître la culture. Il vaut également la peine de se renseigner sur les dommages pour la santé que les concombres peuvent causer.
La teneur en calories du concombre est faible et s'élève à seulement 14 kcal pour 100 g de produit. 95% du légume se compose d'une eau structurée unique, capable de nettoyer le corps des sels de métaux lourds et de la plupart des toxines. La valeur énergétique d'un concombre cuit varie :
- la teneur en calories des cornichons n'est que de 11 kcal;
- la teneur en calories des concombres marinés est légèrement supérieure à celle des concombres crus et atteint 16 kcal pour 100 g.
La valeur nutritionnelle de ce légume est élevée en raison de sa teneur en diverses vitamines et minéraux. La composition chimique des concombres est présentée dans le tableau ci-dessous.
Les avantages des concombres pour la santé humaine sont également associés aux fibres de fibres grossières et insolubles qu'ils contiennent. Ils rétablissent le bon fonctionnement de l'intestin et le nettoient des accumulations de toxines et de calculs fécaux, qui constituent une menace sérieuse.
Les phytostérols présents dans la plante contribuent à la fixation et à l'excrétion de l'excès de cholestérol de l'organisme. Les folates, également présents dans le légume, soutiennent le système vasculaire.
Compte tenu de la richesse de la composition des concombres, en l'absence de contre-indications à leur utilisation, il vaut la peine d'inclure le légume dans votre menu quotidien. La teneur en calories du concombre frais est si faible qu'il ne faut pas s'inquiéter du fait que ce légume endommage la silhouette.

Propriétés utiles pour le corps
Les avantages des concombres pour le corps humain ne font aucun doute, mais seulement si l'utilisation du légume est correcte. Il est important de le consommer en combinaison avec d'autres produits. Vous devez également connaître la mesure de la quantité de concombres consommés, afin de ne pas provoquer d'indigestion. Maximum taux journalier un produit qui peut être consommé au profit du corps - 500 g.Il est particulièrement utile de manger des concombres râpés ou finement hachés. Sous cette forme matériel utile au cours de la digestion, ils sont libérés plus activement des concombres et absorbés plus rapidement dans les intestins.
enfants
Pour les enfants, manger des concombres est un must. Ce légume, en raison de la teneur élevée en eau la plus pure, provoque rarement des allergies et en même temps reconstitue les besoins du corps en la plupart des vitamines et minéraux. Pour la première fois, les concombres sont introduits dans le menu de l'enfant dès l'âge de 12 mois. Donner immédiatement le produit en grande quantité, même si l'enfant l'apprécie beaucoup, cela ne doit pas être dû à l'effet laxatif du concombre sur les intestins.
Initialement, les concombres sont administrés 1 cuillère à café par jour. S'ils sont acceptés positivement par le corps du bébé, la posologie est doublée. Progressivement, une portion de concombres est portée à 5-8 cuillères à soupe par jour.
Les propriétés utiles du concombre pour le corps de l'enfant sont les suivantes:
- prévention de l'anémie - cette propriété d'un légume est associée à sa capacité à éliminer la carence en silicium dans le corps de l'enfant. En l'absence de minéral, des perturbations dans la composition du sang et une baisse du taux de globules rouges se produisent, à cause desquelles se développe une anémie assez persistante, difficile à éliminer sans l'utilisation de médicaments;
- prévention de l'apparition de maladies endocriniennes dans le contexte d'une violation de la glande thyroïde - se produit en raison de la forte concentration d'iode. Même avec une carence importante d'une substance dans le corps, avec l'utilisation régulière de concombres, la carence en iode chez un enfant est éliminée;
- maintenir la santé et normaliser le fonctionnement du système nerveux - le potassium, contenu dans les concombres, a un effet bénéfique sur le système nerveux central et aide les enfants à supporter plus facilement le stress associé au début d'une visite à la maternelle ou à la transition vers la vie scolaire. Le potassium augmente également l'endurance du corps et sa capacité à survivre plus facilement à des charges importantes ;
- amélioration de la fonction cérébrale - cette propriété des concombres est associée à la présence d'eau pure dans leur composition, qui nettoie le corps des toxines et des sels de métaux lourds. Les systèmes et les organes des enfants réagissent rapidement à l'élimination des substances nocives, y compris le cerveau. Lorsque les enfants sont soumis à un stress intellectuel important, les concombres contribuent à faciliter l'assimilation de nouveau matériel et à prévenir l'apparition d'une fatigue cérébrale, dangereuse par l'émergence d'un désintérêt total pour l'apprentissage futur ;
- maintenir un métabolisme de haute qualité - aujourd'hui, en raison de la présence d'un grand nombre d'additifs chimiques dans les aliments, des troubles métaboliques sont de plus en plus observés chez les enfants. Si l'enfant consomme quotidiennement des concombres, un tel problème ne se posera pas pour lui. Cela est dû au fait qu'en normalisant le processus de digestion, le légume élimine également produits dangereux, et régule également le processus d'absorption dans l'intestin, empêchant ses échecs;
- renforcer l'immunité - la propriété immunostimulante des concombres a été confirmée par la recherche médicale. Le légume aide le corps des enfants à mieux résister aux maladies et nettoie les tissus lymphoïdes (principalement les amygdales et les végétations adénoïdes), à partir desquels ils bon travail est restauré et les virus sont bloqués au premier stade de la pénétration dans le corps. Si l'enfant est très souvent malade, il est recommandé de lui donner une salade de concombre râpé avec de l'ail et de l'huile d'olive. Un tel outil est l'immunomodulateur le plus puissant.

Dans le cas où il y a des inquiétudes quant au moment où l'enfant, en raison des particularités de son développement ou de la présence d'une maladie congénitale maladies chroniques vous pouvez donner le produit, vous devriez consulter votre médecin concernant l'introduction de concombres dans l'alimentation.
Quel est le concombre utile pour les femmes
Pour corps féminin le concombre est également très utile, non seulement pour sa faible teneur en calories, mais aussi pour d'autres effets positifs sur le corps.
- Perte de poids. Cet effet est obtenu si les concombres sont consommés quotidiennement. Cela est dû au fait que les substances de la composition du légume aident à empêcher la transition des glucides dans le corps en graisses et interfèrent ainsi avec la formation de cellules graisseuses. Dans une certaine mesure, le produit décompose également les dépôts déjà existants, mais pas assez efficacement pour perdre du poids uniquement en incluant des concombres dans l'alimentation.
- Accélération de la digestion des aliments. Grâce aux concombres, même les aliments gras et lourds sont absorbés beaucoup plus rapidement, ce qui réduit la charge sur le foie et les intestins ; et n'ont pas non plus le temps de former des toxines qui se produisent si le processus de fermentation dans l'intestin commence. De ce fait, non seulement les ballonnements sont éliminés, mais l'état de la peau, des cheveux et des ongles s'améliore également. Aussi, cette propriété du légume stimule la restauration du cycle menstruel, dont les défaillances sont souvent associées à un excès de toxines qui empoisonnent l'organisme.
- Tonification générale du corps. Le jus de concombre a cette propriété. Il suffit de le boire le matin pour éliminer fatigue chronique et restaurer la fermeté de la peau dont la perte trop précoce entraîne rides d'expression et pattes d'oie. De plus, le jus démarre activement le processus de digestion, à partir duquel, même après un petit-déjeuner précipité et inapproprié, il n'y a pas de sensation de lourdeur. Cette boisson élimine complètement le problème de la constipation, qui chez les femmes provoque une couleur de peau grisâtre et un vieillissement prématuré.
- Prévention des maladies veineuses. Les composants de la composition des concombres aident à renforcer les parois vasculaires et à restaurer le bon fonctionnement des valves veineuses. De ce fait, le risque de varices et d'hypertension est réduit, ainsi que la probabilité d'un accident vasculaire cérébral, même à un âge avancé.
Il est particulièrement nécessaire d'utiliser activement les concombres dans la saison où ils sont stockés pendant un minimum de temps et n'ont pas le temps de perdre leurs propriétés bénéfiques.
Les femmes utilisent également la culture comme produit de soin de la peau pour les masques faciaux et les lotions. Ils ralentissent le processus de vieillissement et éliminent les rides. Le masque au concombre peut être fait quotidiennement.
Hommes
Puisqu'il n'y a pas de différences cardinales dans la plupart des processus dans les corps des hommes et des femmes, l'effet des concombres sur le sexe fort n'est pas très différent de celui exercé sur les femmes. De plus, ils stimulent la production de testostérone dans le corps masculin, ce qui aide à maintenir longue durée activité sexuelle et ne pas perdre de cheveux avec l'âge.
Les concombres sont-ils bons pour la grossesse et l'allaitement ?
Pendant la grossesse, les concombres sont non seulement autorisés, mais obligatoires. Un légume lors du portage d'un enfant aide une femme à prévenir la constipation, ainsi que l'œdème, puisque l'élimination excès de liquide du corps réduit la charge sur les reins et vous permet de normaliser la pression artérielle. Le fait que les concombres contribuent à l'élimination de l'excès de liquide est également bénéfique pour le muscle cardiaque.
Dans le même temps, après l'accouchement pendant l'allaitement, il est préférable de refuser les concombres, car certaines des substances de leur composition, pénétrant dans le bébé avec du lait, provoqueront des ballonnements et des coliques chez lui.
Quel est le concombre utile pour le corps lors de la perte de poids
Lorsque vous perdez du poids, un légume vous permet de faire un régime hypocalorique et en même temps de ne pas limiter le corps en vitamines et minéraux essentiels. En améliorant la digestion et le métabolisme, la culture contribue à une perte de poids importante.
La faible teneur en calories du concombre le rend idéal pour les collations, car sa teneur élevée en fibres vous fait vous sentir rassasié plus longtemps, tout en stimulant la combustion des graisses.
Dommages et contre-indications d'utilisation
Concombres frais, dont les avantages et les inconvénients pour le corps intéressent de nombreux amateurs de ce légume, avec une utilisation modérée, ils ne nuiront pas. Si vous en mangez trop, des troubles digestifs peuvent survenir. Il est également important de prendre en compte la présence de contre-indications. Il faut refuser le recours à la culture lorsqu'il y a :
- pathologie hépatique sévère;
- le dernier stade de l'hypertension;
- athérosclérose;
- maladie du rein;
- allaitement maternel.
Même avec des contre-indications, une petite quantité de concombre ne nuira pas et n'aggravera pas votre santé.
Les avantages et les inconvénients des concombres salés et marinés
Sous réserve des contre-indications ci-dessus, les concombres marinés et marinés n'en bénéficieront que. Les cornichons aident à éliminer les bactéries pathogènes de la microflore intestinale et à prévenir son inflammation et son érosion.

Les avantages des cornichons sont la capacité de réduire le niveau de graisses dans le sang. Cette propriété aide à prévenir la survenue de crises cardiaques et de crises hypertensives. Préjudice cornichon ne causera qu'avec une utilisation excessive et le non-respect des contre-indications.
Sous forme marinée, il est recommandé aux personnes d'utiliser un légume pour stimuler l'immunité du fait que l'action des épices qui composent la marinade s'ajoute également à son action. Lorsque vous mangez des concombres marinés, nous devons nous rappeler qu'ils stimulent l'appétit et peuvent provoquer l'obésité. Ne les donnez pas aux enfants de moins de 7 ans, car les enfants tube digestif pas encore bien développé et légumes épicés peut provoquer des dysfonctionnements.
Les légumes salés et marinés peuvent nuire aux personnes qui ont :
- ulcère de l'estomac;
- augmentation de l'acidité de l'estomac;
- la présence de calculs rénaux.

Opinion d'expert
jardinier
Demandez à un expertLes concombres se sont révélés produit utile sous n'importe quelle forme - du frais au mariné. Il est nécessaire de manger des légumes à tout âge, mais seulement si vous abordez cela correctement. Ne sous-estimez pas la culture, considérant qu'elle se compose uniquement d'eau.