Comprendre la « physique » rectification de l'alcool Considérons les principales propriétés de l'alcool éthylique absolu à 100 % :
- point d'ébullition = 78,3°C à 760 mm Hg.
- densité du liquide = 790 kg/m3 à 20°C
On sait que l'alcool éthylique se dissout parfaitement dans l'eau, formant un mélange binaire eau-alcool avec n'importe quelle quantité d'alcool. Ici, vous devez indiquer la différence entre la concentration massique et volumique de l'éthanol dans une solution hydroalcoolique. La concentration massique d'alcool est la masse d'alcool dans la masse de la solution (notée g/g ou % en poids).
Le concept de concentration volumétrique est plus souvent utilisé - il s'agit du volume d'alcool dans le volume du mélange (noté ml/ml ou %vol.). Les valeurs de concentrations volumiques et massiques peuvent varier considérablement en raison de la différence significative de densité de l'alcool (0,79 g/ml) et de l'eau (1 g/ml). Dans ce qui suit, seule la notion de concentration volumétrique sera utilisée ici.
Il est clair que le point d'ébullition d'une solution de deux liquides doit être compris entre leurs points d'ébullition individuels - 100°C pour l'eau et 78,3°C pour l'alcool éthylique (à 760 mm Hg). La dépendance du point d'ébullition (vaporisation) de cette solution, ou, ce qui revient au même, de la température de la vapeur saturée d'eau-alcool sur la concentration d'alcool dans la vapeur est représentée sur la Fig. 1.
Le point A est particulièrement remarquable sur ce graphique avec une concentration de 96,4 % et un point d'ébullition inférieur au point d'ébullition de l'alcool éthylique à 100 %.
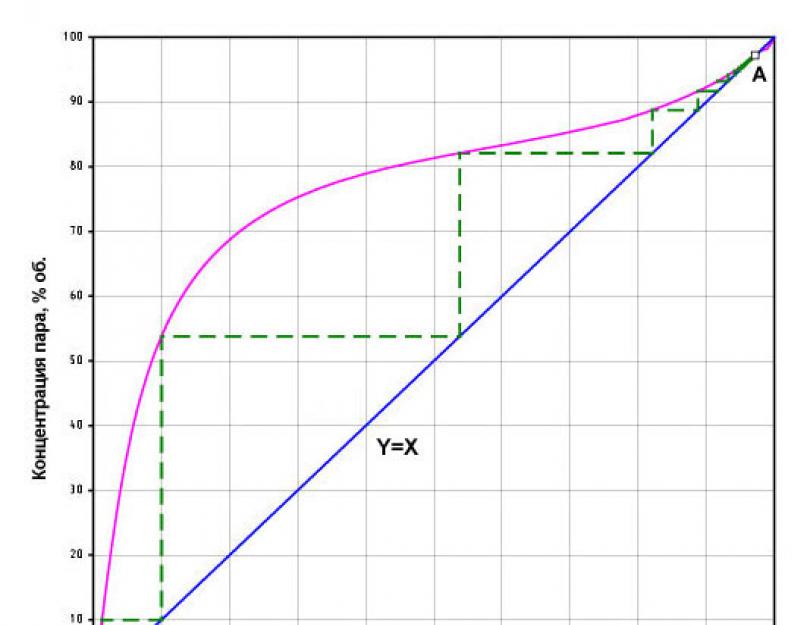
Les processus sont les plus visibles distillation et rectification de l'éthanol expliquer en utilisant la courbe d'équilibre de phase d'un mélange binaire eau-alcool (voir Fig. 2).

Le diagramme montre que presque toute la courbe d'équilibre se situe au-dessus de la diagonale Y=X, c'est-à-dire que lorsqu'une solution hydroalcoolique s'évapore, la concentration d'alcool dans la vapeur est supérieure à celle du liquide d'origine. C’est ce qui sous-tend les processus de distillation et de rectification de l’éthanol.
Le point (A, X=Y=97,2% en volume) d'intersection de la courbe d'équilibre de phase avec la diagonale est d'une grande importance. Il s'agit d'un « point azéotrope » spécial - un mélange liquide inséparablement bouillant de deux composants purs, qui ne peuvent pas être séparés en composants par distillation ou rectification. Le mélange eau-alcool le plus proche possible du point azéotrope est appelé alcool rectifié.
En utilisant la courbe d'équilibre et la diagonale Y=X (voir Fig. 2), vous pouvez voir qu'avec une simple distillation de 10 % de purée, on obtient d'abord un clair de lune avec une concentration d'environ 53 % vol. De plus, après les étapes 10 à 53, vous pouvez créer les suivantes - 53-82, 82-88, 88-92, etc. La composante verticale de l'étape montre une augmentation du pourcentage d'éthanol dans la phase vapeur jusqu'à ce que l'équilibre des phases se produise (point A). La composante horizontale de la marche montre la condensation de ces vapeurs (le point d'intersection de l'horizontale avec la diagonale Y=X). Le schéma montre que pour obtenir de l'alcool rectifié à partir d'un moût avec une concentration initiale de 10 %, il faut théoriquement effectuer plus d'une douzaine de distillations successives de ce type. En pratique, il devrait y en avoir beaucoup plus, donc à mesure que la concentration d'alcool dans le cube de distillation diminue, la concentration du distillat diminue en conséquence. Par exemple, sur la première étape 53% vol. correspond uniquement au moment initial de la distillation. Après un certain temps, la concentration d'alcool dans la purée diminue et nous y avons déjà moins de 10 % d'alcool, de sorte qu'à la fin de la première distillation, le clair de lune sélectionné a une teneur moyenne non pas de 53 % vol., mais 35-40% vol.
Il convient de noter que le point d'ébullition de l'éthanol dépend de la pression atmosphérique (voir Fig. 3). De plus, cette dépendance est assez significative pour le processus de rectification, où chaque dixième de degré compte.

Dans une formulation très, très simplifiée, les « étapes » de distillations individuelles décrites ci-dessus, mais réalisées non pas séparément, mais rassemblées dans un seul appareil, constituent processus de rectification de l'alcool. Une telle installation de rectification a un autre énorme "plus" - parallèlement à la tâche d'obtention d'alcool rectifié, elle résout également le problème de sa purification des impuretés qui ont un point d'ébullition différent de celui de l'alcool (voir le tableau dans l'article Physique - Distillation simple ).
Au-delà de notre objectif de produire de l'alcool, à l'aide d'une colonne de distillation, vous pouvez isoler n'importe quelle substance sous sa forme pure (ce sera particulièrement facile si vous connaissez son point d'ébullition). Par exemple, en distillant une infusion d'aiguilles d'épicéa, on peut tenter d'isoler le composant responsable de l'odeur des aiguilles de pin, ou à partir d'une infusion de pétales de rose, isoler la substance responsable de cette odeur florale. Du moonshiner au parfumeur, il n’y a qu’un pas ;o).
En effet, les colonnes de distillation se déclinent en différents types et présentent parfois une structure très complexe. Vous pouvez voir une description plus approfondie des aspects physiques et technologiques de la rectification sur le site Internet de l'un des plus anciens fabricants.
Nous rencontrons pour la première fois les concepts d'« alcool » et de « solution alcoolique » au cours de nos années scolaires, lorsque nous menons des expériences dans des cours de chimie. Mais avec le temps, les connaissances acquises au cours des études « s'évaporent » faute de possibilité d'application dans la pratique.
En attendant, certaines de ces connaissances scolaires peuvent s’avérer utiles. Il est donc utile de connaître les températures de congélation et d'ébullition pour quiconque souhaite apprendre à distinguer une vodka de haute qualité des contrefaçons, ainsi que... pour les automobilistes. Parlons-en un peu plus en détail.
Dans la plupart des cas, lorsque nous parlons d'alcool, nous entendons l'éthyle - le même type que celui utilisé dans la production d'alcool. Ses caractéristiques sont le point de congélation et le point d'ébullition. Ainsi, si l’on prend en compte l’alcool éthylique pur, il gèlera à une température très basse : -110ºС.
Que signifie « geler » ? Si on passe aux langages de la chimie, cela veut dire « passera de liquide à solide" Le point de congélation est également appelé point de fusion. Bien entendu, il est impossible d’atteindre de telles valeurs dans les conditions quotidiennes.
Pourquoi est-ce que parfois, lorsque nous sortons du congélateur une bouteille de vodka oubliée depuis longtemps, nous sommes surpris d'y trouver des morceaux de glace ?
Solution eau-alcool
Le fait est que la vodka n’est pas de l’alcool pur, mais une solution d’eau dans laquelle est présente une certaine proportion d’alcool. En fonction de cette proportion, la température de congélation change.
La « dispersion » des valeurs auxquelles la vodka subit la cristallisation est de -27ºС à -34ºС. Ce sont des chiffres approximatifs. Plus la vodka contient d’éthanol, plus la limite sera basse pour qu’elle puisse passer de l’alcool liquide à, pour ainsi dire, une « glace alcoolisée ».

Ce qui suit est intéressant : le processus de congélation se produit progressivement, la vodka s'épaissit, se transformant en une sorte de gelée, et seulement après cela, si la température ne change pas, elle devient solide. Et il ne gèle presque jamais complètement.
Cause: Premièrement, les particules d’eau changent de caractéristiques : elles deviennent de petits morceaux de glace. La concentration d'alcool dans la bouteille devient plus élevée, la solution a donc besoin d'une température plus basse pour devenir de la glace.
Il est peu probable que des conditions puissent se créer dans le réfrigérateur lorsque la température descend à -33 ou -40. C'est tout simplement techniquement impossible dans la vie de tous les jours, même si le congélateur fonctionne correctement. Par conséquent, il est peu probable que vous observiez une transformation complète en glace, mais il est fort probable qu'il y ait des morceaux de glace dans une bouteille.
Table de congélation pour solution hydroalcoolique
Avez-vous quelque chose à ajouter à notre article ? Nous sommes prêts à publier vos commentaires sur le sujet - ils seront utiles à tout le monde. Écrivez, nous partagerons nos connaissances !
Salut tout le monde!
Dernièrement, on m'a souvent posé les questions suivantes : à quelle température faut-il distiller le clair de lune ? Ou, comment distiller du clair de lune à l'aide d'un thermomètre installé dans un cube de distillation ? Etc.
En effet, de telles questions se posent chez la plupart des distillateurs débutants. Aujourd'hui, je vais essayer de répondre à ces questions et de vous dire si un thermomètre est généralement nécessaire dans un alambic Moonshine et ce qu'il nous apporte.
Tout d'abord, je voudrais attirer votre attention sur le fait que cet article est consacré au travail sur un alambic moonshine classique, composé d'une cuve et d'un refroidisseur. Ou sinon bateau à vapeur entre la cuve et le distillateur. Le thermomètre est installé dans le cube de distillation.
Pour les équipements plus complexes, des règles différentes s’appliquent. Par exemple, pour travailler sur une rubrique cinéma, j'ai article séparé.
À quoi sert un thermomètre dans un alambic Moonshine ?
Je vais maintenant énumérer brièvement les avantages de cet appareil et, dans la section suivante, j'expliquerai comment les mettre en pratique.
- La capacité de déterminer avec précision le début de la distillation, permettant ainsi d'économiser de l'eau en ouvrant son alimentation uniquement lorsque cela est nécessaire.
- Déterminez la force initiale de la purée.
- Déterminez l'intensité du courant du clair de lune à la sortie du réfrigérateur, éliminant ainsi le besoin d'utiliser des densimètres pendant la distillation.
- Passez de la sélection du corps à la sélection de la queue en temps opportun.
- Compléter la sélection des résidus et toute la distillation en temps opportun.
- Calculez l'alcool restant dans le cube.

Comment contrôler le processus de distillation par température
Comme vous le savez, l’alcool éthylique bout à une température de 78,4 °C (à une pression atmosphérique de 760 mmHg). Mais la purée ou l'alcool brut est une solution eau-alcool ( impuretés négligé), et donc le point d’ébullition de cette solution est différent et dépend de la teneur en éthanol qu’elle contient. De plus, à une certaine quantité d'alcool dans la purée correspond une certaine quantité d'alcool dans la vapeur entrant dans le refroidisseur.
Vous trouverez ci-dessous un tableau de la dépendance de la température d'ébullition de la purée (ou de la purée crue) sur la teneur en alcool qu'elle contient.

La tablette est simple, mais je vais quand même vous expliquer comment l'utiliser.
- Lors de la distillation de la purée
- Disons que vous avez versé 10 litres de purée.
- La purée a bouilli et la sélection a commencé à 92 degrés, la force du liquide est donc d'environ 12 %. Il suffit de se concentrer non pas sur les toutes premières gouttes, mais sur le moment où un joyeux filet commence et que la température se stabilise. Hier, mes premières gouttes sont apparues à 88-89 degrés, mais la température a très vite atteint 93 puis a commencé à augmenter très lentement - de 0,1 degré. C’est le numéro sur lequel vous devez vous concentrer.
- Nous conduisons le clair de lune à 98-99 °C, selon votre gourmandise et votre patience. Je le conduis habituellement jusqu'à 98. Je ne recommande toujours pas de monter jusqu'à 100 degrés - la perte de produit sera insignifiante, mais vous perdrez beaucoup de temps et en même temps collecterez beaucoup d'impuretés inutiles.
- Lors de la distillation de l'alcool brut
- Nous avons effectué, disons, 20 % de tri.
- À l'aide du tableau, nous déterminons que le point d'ébullition du mélange est de 88 à 89 degrés. Il n'est donc pas nécessaire d'ouvrir l'eau avant 80 °C et vous pouvez la conserver.
- Dans la plupart des méthodes, et dans la mienne aussi article sur la distillation, il est recommandé de prélever jusqu'à 40 % du corps dans le ruisseau (ou pendant qu'il brûle). Cela correspond à une température de 95-96 °C. Ceux. Avec un tel chauffage, vous pouvez procéder à la sélection des résidus. Pour l’avenir, je tiens à dire que selon mes dernières données, il vaut mieux passer aux queues à 93-94 °C. Oui, de cette façon, nous envoyons une grande quantité d'alcool aux résidus, mais à partir de ces résidus, il sera alors possible d'extraire une quantité décente de clair de lune de bonne qualité. Je vous expliquerai pourquoi il est nécessaire de compléter la sélection du corps à 93 °C dans un des articles suivants, lorsque j'organiserai les informations reçues.
- Nous sélectionnons des queues à 98-99 degrés.
Le point d'ébullition de l'alcool dans la purée varie, mais ne pensez pas que maintenir un régime optimal n'a aucune importance. Le maintien du régime de température est considéré comme l'un des éléments importants du processus d'obtention d'un clair de lune de haute qualité.
Dans le processus de maturation du moût, la température joue presque le rôle principal, cette règle s'applique également à la distillation. Lorsque la purée fermente, elle génère de la chaleur, et le maintien d'un certain niveau de température aura un impact direct sur le processus de fermentation lui-même et sur la qualité des matières premières.
Point d'ébullition de l'alcool dans la purée
Pendant le processus de distillation, les degrés ne sont pas non plus mesurés par souci d'intérêt - ils aident à couper les « queues » et les « têtes ».
La température de fermentation de la purée pour le clair de lune dépend de plusieurs facteurs, le chiffre optimal est considéré comme étant de 25 à 28 degrés. Mais n'oubliez pas que la levure, en cours d'activité vitale, c'est-à-dire lorsqu'elle absorbe le sucre et le transforme en alcool, produit de la chaleur.
Braga for moonshine est préparé selon plusieurs règles. Mais même une purée de haute qualité ne se transformera pas en clair de lune, qui aura des caractéristiques élevées si le régime de température n'est pas respecté.
Alors, des conseils pour maintenir la température, ou des règles pour faire un moût de qualité :
- Le breuvage « correct » fermente à une température de 25 à 26 degrés. Si la température monte jusqu'à 30 degrés, il n'y a pas de quoi s'inquiéter.
- Abaisser la température à 17-18 degrés peut amener la levure à « s'endormir ». Le processus de fermentation s'arrêtera, mais il pourra reprendre.
- Lorsque la température augmente, les micro-organismes cessent de fonctionner, ils meurent tout simplement et le processus de fermentation ne peut pas reprendre. Il faudra verser la purée et en mettre une nouvelle.
Pour surveiller la température, les distillateurs équipent le récipient à purée de thermomètres et surveillent le régime. Cependant, tu dois faire attention non seulement à la température de la pièce, mais aussi à la période de l’année.
Les Moonshiners conseillent :
- S'il fait frais dehors et à l'intérieur aussi, il est préférable d'ajouter un peu plus de levure à la purée - cela aidera à accélérer le processus de fermentation. Mais en retour, la boisson aura un arôme caractéristique, qui peut être considéré comme la marque distinctive du clair de lune.
- Lorsque la température ambiante est stable, chaude et qu'il n'y a pas de courants d'air, vous pouvez modifier légèrement les proportions et ajouter un peu moins de levure. Cela n'affectera pas de manière significative le processus de fermentation, mais améliorera la qualité du produit.
- Moonshine peut être affecté par l'utilisation d'un chauffe-aquarium, mais ne surchauffez pas l'infusion, car cela ne mènera à rien de bon. Lorsque la température atteint 40 degrés, les micro-organismes meurent ; ce processus est irréversible. Si les champignons « hibernent » simplement, une augmentation de la température aidera à les faire revivre.
Tableau des températures
Tableau de température qui aidera dans le processus de préparation de la purée.
Les problèmes commencent lorsque la température dans le récipient dépasse 30 degrés. Pour cette raison, vous devez surveiller attentivement le régime et, si nécessaire, réduire ou augmenter les degrés. Cela vous aidera à terme à obtenir un produit de haute qualité qui, une fois correctement distillé, se transformera en un alcool agréable et onctueux.
Distillation du moût : procédé et entretien
La température de distillation du moût est d'une importance directe. L'indicateur est surveillé à l'aide d'un thermomètre ordinaire. Le distillateur est équipé de divers appareils, la température dans le cube est surveillée en prenant des lectures sur le cube de distillation. Les diplômes aident à réaliser une distillation fractionnée et à compléter la sélection de l'une ou l'autre fraction dans le temps.
Le processus d'évaporation est divisé en plusieurs étapes. L'eau s'évapore à une température, l'alcool à une autre et les huiles de fusel commencent à bouillir à une troisième température.
Pour obtenir un produit de haute qualité, séparez l'alcool du lait de fusel et obtenez un bon clair de lune, le suivi des indicateurs vous aidera.
Le processus peut être divisé en plusieurs étapes :
- Première étape : maintenir l'indicateur entre 63 et 68 degrés.
- Nous augmentons le degré à 78.
- 85 degrés - nous commençons à sélectionner la partie « queue ».
Si le distillateur et la purée versée dans le cube de distillation sont chauffés à 65-67 degrés, l'évaporation des huiles de fusel et de l'alcool commencera. Les premières gouttes de la précieuse eau ardente apparaîtront. Mais il n'est pas recommandé d'en boire. Les gens appellent ce clair de lune pervak et le considèrent comme de haute qualité et solide. En fait, ce mélange peut difficilement être appelé clair de lune.
Pervak contient une énorme quantité d'impuretés, de l'alcool méthylique à l'acétone. Cette boisson enivre rapidement, elle provoque de graves intoxications et frappe durement les reins et le foie. Vous ne devez pas boire de pervak, il est collecté dans un récipient séparé et utilisé uniquement pour des besoins techniques.
Chez les distillateurs, les pervak sont appelés « têtes » ; ils sont coupés et non utilisés ; ils ne peuvent pas être consommés. Sur le volume total en pourcentage, la quantité de pervak est d'environ 8 à 10 %.
Lorsque l'indicateur monte à 63 degrés, le chauffage se produit à la température maximale, puis le degré diminue, moment auquel la température devrait être d'environ 64 à 68 degrés. Si l'indicateur ne diminue pas, des problèmes surgiront : la purée finira dans le réfrigérateur et dans d'autres parties du distillateur, et le clair de lune finira par acquérir l'odeur caractéristique du fusel et une couleur trouble. Même si un distillateur avec un cuiseur à vapeur est utilisé, cela n'aidera pas à empêcher l'alcool de se détériorer du goût et de l'odeur.
Une distillation répétée aidera à corriger la situation : elle améliorera considérablement la qualité du clair de lune et affectera son goût et son arôme.
Ensuite, nous passons à une nouvelle étape : la collecte du clair de lune principal. Il est conseillé de remplacer le joint vapeur. Vous pouvez simplement le retirer et le rincer à l'eau froide, puis placer un récipient pour récupérer le produit principal. Dans le même temps, la température est maintenue à 78 degrés, c'est à ce moment que l'alcool commence à s'évaporer activement. Lorsque la condensation se produit (collision de l'eau froide et de la vapeur d'alcool), le processus de séparation du distillat commence.
Lorsque l'indicateur atteint 78 degrés, la libération du soi-disant « corps » commencera, qui peut être utilisé pour un usage interne.
Progressivement, la température augmentera et en même temps le rendement du produit diminuera. Lorsque le liquide chauffe jusqu'à 85 degrés, les huiles de fusel commencent à se libérer. L'introduction de lait de fusel dans le produit principal modifie sa qualité : la couleur du clair de lune devient trouble, il aura une odeur désagréable et piquante.
Mais le processus de distillation ne s’arrête pas là. Nous passons à la troisième étape, appelée sélection des « queues ».
À des températures de 85 degrés et plus, une certaine quantité d'alcool reste dans la base. Mais il y en a si peu qu'il n'est plus possible d'obtenir le produit sous une forme pure ou relativement pure. Pour cette raison, les moonshiners commencent à sélectionner la dernière partie.
La fraction appelée « queues » a une faible résistance et une odeur âcre. Un tel clair de lune sera trouble, ce qui indique également sa qualité douteuse.
Le distillateur produit des « queues » jusqu'à ce que la force du jet descende à 20 degrés. Puis la collecte de cette fraction est arrêtée et la distillation est terminée. À ce stade, le processus de clair de lune peut être considéré comme terminé.
Il existe une alternative à la distillation : la congélation. Le processus demande beaucoup de travail, mais est assez intéressant. Le fait est que l'eau gèle à une température et l'alcool à une autre. La congélation a peu d’effet, mais vous pouvez l’essayer juste pour le plaisir.
Distillation sans thermomètre
Souvent, vous n’avez tout simplement pas le bon appareil à portée de main. Si, pour une raison ou une autre, il n'est pas possible de mesurer la température, vous pouvez alors profiter de l'expérience des distillateurs et arrêter de sélectionner le produit principal si certains signes apparaissent.
Quand arrêter de sélectionner le « corps » :
- Le clair de lune de haute qualité brûle bien, la flamme est uniforme et sa couleur diffère. Lorsqu'un papier ou une serviette imbibée d'alcool ne brûle pas bien ou s'éteint, vous devez arrêter de collecter du clair de lune.
- Lorsque la température atteint 83 degrés, le débit de distillat non seulement diminue, mais tombe à zéro, c'est-à-dire qu'il s'arrête complètement.
- De nombreux moonshiners savent que dès que la force du courant descend en dessous de 40 degrés ou se situe approximativement dans cette plage, la collecte de la fraction principale est arrêtée et les « queues » commencent à être sélectionnées.
- Vous pouvez utiliser une autre méthode : il suffit de sentir le clair de lune. Les « têtes » et les « queues » ont une odeur plutôt piquante, ce qu'on ne peut pas dire de la partie principale.
Dans certains cas, la première distillation est réalisée sans séparation en fractions, la température du moût lors de la distillation ne joue alors pas de rôle particulier. Mais lors du retraitement, vous devrez surveiller les degrés, sinon cela affectera la qualité du clair de lune, ses caractéristiques gustatives, etc.
Lorsque vous produisez de l'alcool à la maison, il convient de suivre toutes les nuances et de contrôler le processus. Si vous manquez quelque chose, vous pouvez vous retrouver avec un produit de mauvaise qualité. Cependant, presque toutes les erreurs peuvent être corrigées.
Lors de la distillation du vin, le principal produit entrant dans la composition du distillat est l’alcool éthylique. Mais une simple distillation ne peut pas obtenir de l’alcool éthylique pur ; il sera toujours accompagné de diverses impuretés - autres alcools, aldéhydes, esters, acides volatils que l'on retrouve dans le vin (tableau 28).
En fonction du point d'ébullition, toutes les impuretés peuvent être divisées en deux groupes : les impuretés à bas point d'ébullition avec un point d'ébullition inférieur à celui de l'alcool éthylique et les impuretés à haut point d'ébullition avec un point d'ébullition supérieur à 78,3°.
| Substances | Point d'ébullition | Formule chimique | Remarques |
|---|---|---|---|
| Alcools monobasiques | |||
| Méthyle | 65,0 | CH4O | - |
| Éthyle | 78,3 | C2H6O | Odeur et goût agréables |
| Propyle | 97,4 | C3H8O | Odeur piquante agréable |
| Isopropyle | 82,1 | C3H8O | - |
| Butyle | 117,5 | C4H10O | Bonne odeur |
| Isobutyle | 108,4 | C4H10O | Forte odeur, goût de brûlé |
| L'amyle (optiquement actif) est le composant principal des huiles de fusel | 128,0 | C5H12O | Odeur suffocante désagréable |
| Isoamyl | 132,0 | C5H12O | - |
| Hexyl et autres alcools élevés (en très petites quantités) | 157,2 | C6H14O | Bonne odeur |
| Alcools dihydriques | |||
| Isobutylglycol | 178,5 | C4H11O2 | Pas d'odeur, légèrement sucré |
| Glycérol | 275,0 | C3H8O3 | Goût sucré et inodore |
| Aldéhydes | |||
| Acétique | 20,8 | C2H4O | Liquides insipides avec une odeur piquante et désagréable, produits d'oxydation fragile des alcools ; s'oxyde en acide acétique |
| Propyle | 50,0 | C3H6O | |
| Huile | 75,0 | C4H8O | |
| Furfural | 162,0 | C3H4O | Odeur d'amandes amères |
| Éthers | |||
| Antéthyle | 54,15 | C3H6O2 | Bonne odeur |
| Acétate d'éthyle | 77,05 | C4H8O2 | |
| Isobutyrique-éthyle | 110,1 | C6H12O2 | |
| Éthyle isovalérique | 134,3 | C7H14O2 | |
| Acides | |||
| Gaz carbonique | - | CO2 | - |
| Vinaigre | 118,1 | C2H4O2 | Formé par l'oxydation de l'alcool éthylique |
| Propionique | 140,9 | C3H6O2 | - |
| Huileux | 162,3 | C4H8O2 | Odeur désagréable d'huile rance |
| Valériane | 185,6 | C5H10O2 | Produit d'oxydation de l'alcool amylique, odeur désagréable |
| Nylon | 205,0 | C6H12O2 | - |
| Énanthique | 223,5 | C7H14O2 | - |
La quantité d'impuretés à bas point d'ébullition est insignifiante et varie en fonction de la composition du vin distillé et de la méthode de distillation. Certaines des impuretés qui bout à une température plus élevée que l’alcool éthylique sont des alcools plus élevés. Beaucoup de ces alcools ont une odeur âcre et un goût désagréable, et donc leur présence notable dans les jeunes spiritueux de cognac réduit la qualité de ces derniers. Lors de la production de spiritueux de cognac, des mesures sont prises pour éliminer les impuretés indésirables, ce qui est obtenu par distillation fractionnée.
En plus des alcools, des aldéhydes sont également distillés : acétiques, propyliques, butyriques et à partir d'aldéhydes supérieurs - le furfural, obtenu lors du processus de distillation à partir des pentoses.
Lors de la distillation, les acides volatils passent également dans la distillation : acétique, lactique et autres - et les esters. Parmi les acides, l’acide acétique est le plus important. Lors de la distillation de vins normaux et sains, sa quantité dans le distillat est insignifiante et une partie de l'acide acétique participe à la formation d'esters au cours du processus de distillation. Lorsqu'ils sont distillés, les vins malades produisent un distillat contenant une quantité importante d'acide acétique, ce qui rend souvent l'alcool totalement impropre à la production de cognacs.
Parmi les esters qui passent du vin dans l'alcool de cognac, il faut d'abord signaler l'éther éthylacétylique dont la quantité, comme l'acide acétique, dépend de l'état du vin distillé. Lors de la distillation de vins malades, une quantité importante d'éther d'acide acétique peut passer dans le distillat, ce qui, bien entendu, affectera négativement le goût et l'arôme de l'alcool de cognac. Outre l'éther éthylacétylique, d'autres esters contenus dans le vin en petites quantités sont transférés dans l'alcool de cognac, qui sont très divers selon les acides et alcools impliqués dans leur formation.
Lors du processus de distillation, ces esters ne passent pas complètement en distillation ; une partie plus ou moins importante d'entre eux est distillée, selon les conditions de distillation. Les esters qui entrent dans la distillation peuvent également se former lors du chauffage au cours du processus de distillation, et d'autre part, les esters présents dans le vin dans les mêmes conditions peuvent être détruits par hydrolyse (saponification).
La distillation du vin pour produire de l'alcool de cognac commence peu après la fin de la saison viticole et ne se poursuit pas plus longtemps que jusqu'au 1er mai de l'année suivant la récolte. Habituellement, après avoir retiré le vin des sédiments de levure, sans attendre une clarification complète, ils commencent à le distiller.
La différence entre la production de spiritueux de cognac et d'alcool éthylique rectifié est que dans la production d'alcool rectifié, ils s'efforcent, si possible, de le purifier complètement des impuretés volatiles. Dans la production de cognac, au contraire, des mesures sont prises pour préserver certaines de ces impuretés (à moyen terme), car elles déterminent le développement de l'arôme et du goût particuliers du cognac au cours du vieillissement des alcools.
Par conséquent, le processus de distillation des matières viticoles de cognac et de l'alcool de cognac brut, soumis à la loi générale de la distillation, nécessite une approche particulière de la part du maître de cognac et la capacité de l'orienter dans la direction souhaitée pour obtenir un distillat qui contiendrait certaines impuretés. et, avec le vieillissement, pourrait développer les qualités spécifiques inhérentes aux eaux-de-vie de cognac.
Le processus de distillation (distillation) de mélanges liquides est basé sur le fait que les liquides qui composent le mélange ont une volatilité différente, c'est-à-dire qu'à la même température, ils ont des pressions de vapeur différentes.
En raison de la différence de pression de vapeur des liquides qui composent le mélange, la composition de la vapeur et, par conséquent, la composition du liquide résultant de la condensation de cette vapeur différera de la composition du mélange distillé initial ; la vapeur contiendra plus de composants plus volatils que le liquide distillé.
Dans sa forme la plus simple, la distillation est similaire au processus d’évaporation, mais il existe des différences significatives entre les deux. L'évaporation concerne des solutions constituées d'un solvant volatil et d'un solide dissous non volatil. À la suite de l'évaporation, une partie du solvant est éliminée et la concentration de la solution augmente, et le reste, qui ne se transforme pas en vapeur, est le produit final du processus d'évaporation.
La distillation concerne des solutions dans lesquelles le solvant et le soluté sont volatils, de sorte que lorsque ces solutions s'évaporent en vapeur, le solvant et le soluté sont convertis simultanément en quantités correspondant à leur volatilité. À la suite de la distillation, une séparation complète ou partielle de la solution en ses composants constitutifs est obtenue.
Un équilibre de phase mobile s'établit entre le liquide (mélange) et la vapeur au-dessus dans un récipient fermé : en raison du mouvement thermique des molécules, le même nombre de molécules passent du liquide dans l'espace de vapeur par unité de temps que celles qui reviennent de la vapeur au liquide.
Si le vin est distillé, la vapeur est toujours plus riche en alcool que le vin bouillant, car l'alcool est plus volatil que l'eau. Dans la pratique de la distillation du vin, on observe que lorsque le vin s'évapore de moitié, tout l'alcool s'en évapore. Dans ce cas, il est possible de condenser et de collecter dans les produits de distillation, qui ont la moitié du volume par rapport au liquide prélevé, la totalité de l'alcool contenu dans le liquide. En répétant la même opération avec le condensat obtenu jusqu'à évaporation complète de l'alcool, on obtient la même quantité d'alcool dans un volume encore plus petit, c'est-à-dire qu'il sera plus concentré. Ainsi, il est possible de séparer l'alcool de l'eau dans une limite dépendant de la conception de l'appareil utilisé, et d'obtenir un alcool à haute concentration.
Le titre d’une solution hydroalcoolique (alcool éthylique) est le pourcentage d’alcool anhydre dans cette solution. Le titre est exprimé en pourcentage en poids, indiquant la teneur pondérale en alcool (en g) en 100 g solution, ou en pourcentage volumique indiquant la teneur en alcool volumique (en ml) pour 100 ml solution. Beaucoup moins souvent, ils ont recours à la mesure de la teneur en grammes d'alcool pour 100 ml solution (pourcentage de concentration). Le volume de la solution change en fonction de la température. Par conséquent, la concentration d’une solution hydroalcoolique en pourcentage volumique se réfère à une température, appelée normale.
GOST 3639-50 « Solutions eau-alcool. La méthode de détermination du titre stipule que le titre d'une solution hydroalcoolique est exprimé en pourcentage volumique à une température normale de +20°. Le volume d'une solution hydroalcoolique est exprimé en litres à une température de solution de 4-20°. Il s'ensuit qu'en 100 je solution hydroalcoolique titrant par exemple 45 % vol. à 20° contient 45 je alcool anhydre.
L'alcool éthylique bout à une température de 78,3° (à une pression de 760 mm art. Art.), et le point d'ébullition d'un mélange d'eau et d'alcool est plus proche du point d'ébullition de l'eau (100°), plus sa teneur relative dans le mélange est élevée. Étant donné que l'alcool éthylique s'évapore plus rapidement que l'eau, la composition du mélange distillé se rapproche progressivement de l'eau.
Pour caractériser le processus de distillation, la relation entre la teneur en alcool des mélanges eau-alcool, le point d'ébullition de ces mélanges et la teneur en alcool de la vapeur dégagée lors de l'ébullition revêt une importance particulière. Dans le tableau 29 montre le titre du distillat obtenu par distillation unique d'un mélange eau-alcool de titre connu.
De la table 29, il est clair qu'avec une augmentation de la teneur en alcool dans le liquide redistillé, sa concentration dans les vapeurs dégagées par le col augmente relativement et, par conséquent, le degré de renforcement obtenu diminue - le coefficient de renforcement, qui diminue continuellement avec l'augmentation force du liquide à distiller.
Selon le mode (type d'appareil utilisé) lors de la distillation du vin, le rapport entre la teneur en alcool du vin bouillant et la vapeur condensée dans les alambics à feu et les alambics à vapeur fonctionnant selon la méthode de double distillation, selon les recherches de Falkovich, change comme suit (tableau 30).
Ces données confirment une fois de plus qu'avec une diminution progressive de la teneur en alcool du vin, celui-ci va former des vapeurs de plus en plus pauvres en alcool.
La question du comportement des impuretés de l'alcool méthylique contenues dans le vin lors du processus de distillation fait l'objet d'une attention particulière.
L'hypothèse selon laquelle l'ordre de transition des impuretés volatiles dans le Yutgon est associé uniquement au point d'ébullition doit être catégoriquement rejetée. Il a été établi que le processus de purification de l'alcool éthylique des impuretés est déterminé par le degré de dissolution de ces impuretés dans les solutions hydroalcooliques. La possibilité de séparer les impuretés pendant le processus de distillation dépend du coefficient de rectification d'une impureté donnée [Fertman, 123], qui est le rapport du coefficient d'évaporation de l'impureté au coefficient d'évaporation de l'alcool éthylique.
| Appareil à cubes de feu | Appareil à vapeur fonctionnant selon la méthode de double distillation | ||
|---|---|---|---|
| teneur en alcool dans la vapeur condensée | teneur en alcool du liquide bouillant en % vol. | teneur en alcool dans les vapeurs condensées en % vol. | |
| 28,3 | 76,3 | 22,3 | 77,7 |
| 20,5 | 73,1 | 20,6 | 75,6 |
| 15,4 | 68,4 | 15,5 | 70,2 |
| 10,0 | 58,5 | 10,0 | 61,0 |
| 9,1 | 54,3 | 8,3 | 57,7 |
| 7,4 | 51,8 | 7,8 | 57,3 |
| 6,4 | 48,3 | 6,5 | 52,5 |
| 3,4 | 34,0 | 3,3 | 39,2 |
| 0,7 | 9,4 | 1,5 | 20,0 |
Dans le tableau 31 montre les valeurs des coefficients de rectification (selon Fertman) pour certaines des principales impuretés de l'alcool éthylique, et sur la Fig. 178, ils sont donnés graphiquement.
| Titre alcoométrique en % vol. | Acétaldéhyde | Alcool isoamylique | Éther éthylique formique | Éther d'acétate de méthyle | Éther d'acétate d'éthyle | Ester isoamylique acétique | Éther éthylique isovalérique | Ester isoamylique isovalérique | Éther éthylique isobutyrique |
|---|---|---|---|---|---|---|---|---|---|
| 95 | 3,29 | 0,22 | 5,08 | 3,78 | 2,09 | 0,549 | 0,797 | 0,299 | 0,897 |
| 90 | 3,34 | 0,26 | 4,01 | 1,07 | 2,37 | 0,688 | 0,882 | 0,434 | 1,07 |
| 80 | 3,25 | 0,36 | 4,25 | 1,30 | 2,77 | 0,74 | 1,20 | 0,463 | 1,30 |
| 70 | 3,08 | 0,44 | 4,61 | 1,96 | 3,07 | 0,94 | 1,45 | 0,700 | 1,96 |
| 60 | 2,86 | 0,61 | 4,92 | 3,23 | 3,30 | 1,307 | 1,76 | 1,00 | 3,23 |
| 50 | - | 0,80 | 5,26 | - | 3,86 | 1,886 | - | - | - |
| 40 | - | 1,05 | 5,83 | - | 4,77 | - | - | - | - |
| 30 | - | 1,30 | - | - | 5,43 | - | - | - | - |
| 25 | - | 2,02 | - | - | 5,47 | - | - | - | - |
| 10 | - | - | - | - | 5,69 | - | - | - | - |
Lorsque le coefficient de rectification est supérieur à un, l'impureté devient une impureté de tête ; lorsqu'il est inférieur à un, elle devient une impureté de queue. Ainsi, le fait que dans un appareil particulier, par exemple, l'huile de fusel devienne le flux de tête ou de queue, dépendra du coefficient de rectification de l'alcool isoamylique - le composant principal de l'huile de fusel.
Les coefficients de rectification ne sont pas les mêmes pour différentes impuretés ayant la même teneur en alcool éthylique dans le mélange distillé. Le coefficient de rectification d’une même impureté change avec différents titres alcoométriques. Ainsi, les mêmes impuretés volatiles, selon la teneur en alcool éthylique du liquide distillé, peuvent être en tête ou en queue. Ainsi, par exemple, si l'alcool éthylique dans le liquide distillé ne contient pas plus de 42 % en volume, l'alcool isoamylique, qui est le composant principal de l'huile de fusel, s'évapore plus rapidement que l'alcool éthylique. Si la teneur en alcool éthylique dans le liquide distillé dépasse 42 % en volume, l'alcool isoamylique par rapport à celui-ci constituera un courant résiduaire.