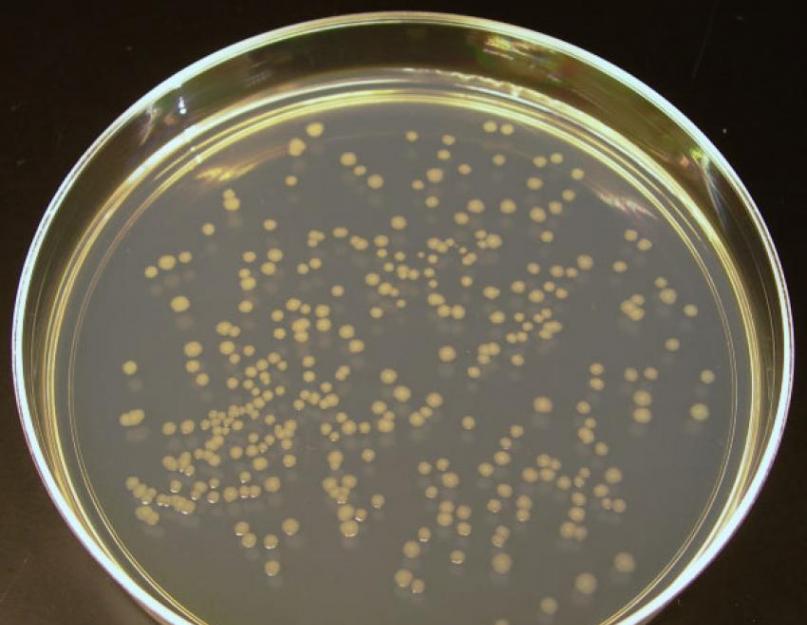
L'invention concerne le domaine de la microbiologie, à savoir la détermination de la contamination des aliments. Le procédé consiste à préparer de la gélose viande-peptone, à la verser dans des boîtes de Pétri, à prélever des échantillons de produits alimentaires, à préparer une suspension à partir d'un échantillon de produits alimentaires, à préparer des dilutions décimales de la suspension d'essai et à placer des dilutions décimales de la suspension d'essai dans des boîtes de Pétri. cultiver et compter le nombre de colonies selon la formule : x=a n ×10, n - degré de dilution. De plus, pour préparer des dilutions décimales de la suspension d'essai, une solution à 0,6-0,8 % de gélose viande-peptone est utilisée, tandis que les dilutions décimales de la suspension d'essai sont placées sur des filtres à membrane situés à la surface de la gélose viande-peptone dans une chambre de Petri. plat. La méthode est originale dans sa solution, facile à mettre en œuvre, informative et donne des résultats statistiquement fiables ; permet de réduire significativement la consommation de milieux de culture, de verrerie bactériologique stérile et le temps d'analyse ; vous permet de donner une véritable évaluation quantitative du contenu en micro-organismes qui donnent une croissance confluente et forment de très petites colonies, et vous permet également d'étudier les processus intrapopulations en utilisant la microscopie optique. 1 ill., 1 onglet.
L'invention concerne le domaine de l'examen vétérinaire et sanitaire, de l'assainissement et de la microbiologie, notamment la détermination de la contamination de produits alimentaires et de l'état sanitaire et hygiénique d'objets environnementaux.
La méthode la plus proche consiste à déterminer le nombre de micro-organismes dans saucisses et les produits carnés dans l'eau. Méthode connue la détermination du nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs dans 1 g de produit est la suivante : préparer une solution pour dilution et une gélose viande-peptone pour l'inoculation ; effectuer une analyse; comptabilisation des résultats. 1. Inconvénient méthode existante est que la solution de chlorure de sodium (0,85 %) utilisée pour diluer les échantillons est non tamponnée et isotonique uniquement par rapport aux cellules de mammifères, et qu'une grande quantité de milieu nutritif, de verrerie bactériologique et de temps de travail sont également utilisés pour l'analyse. De plus, cette méthode ne permet pas une véritable évaluation quantitative de la teneur en micro-organismes qui donnent une croissance confluente et forment de très petites colonies (ressemblant à de la rosée) (Méthodes de bactériologie générale. Edité par F. Gerhard et al. M. : « Mir", 1983, p. 442-512).
L'objectif de l'invention est de réduire la quantité de milieu nutritif utilisée, de verrerie bactériologique et le coût du temps de travail en utilisant une solution physiologique de MPA semi-liquide au lieu d'une solution de chlorure de sodium à 0,85%, suivie d'un ensemencement d'une goutte d'un tester la suspension sur la surface d’un filtre à membrane.
Application cette méthode est basé sur le fait qu'une solution physiologique de gélose semi-liquide viande-peptone (0,6-0,8%) est utilisée comme solution physiologique pour dilution, composée de 1 dm 3 d'eau distillée, 10 g de peptone, 5 g de sodium chlorure, 0,3 g de KN 2 PO 4 anhydre, 0,6 g de NaH 2 PO 4 anhydre et 0,6-0,8 g d'agar-agar ; Le pH du milieu est de 7,0 à 7,2, dont des gouttes sont appliquées à la surface des filtres à membrane.
L'utilisation de (0,6-0,8% de gélose semi-liquide viande-peptone) comme solution de dilution suivie de l'ensemencement d'une goutte de la suspension diluée à tester sur une membrane filtrante est une solution originale, facile à mettre en œuvre, informative et donne des résultats statistiquement fiables. ; permet de réduire significativement la consommation de milieux de culture, de verrerie bactériologique stérile et le temps d'analyse ; vous permet de donner une véritable évaluation quantitative du contenu en micro-organismes qui donnent une croissance confluente et forment de très petites colonies (ressemblant à de la rosée), et vous permet également d'étudier les processus intrapopulations en utilisant la microscopie optique.
Pour effectuer l'analyse, des échantillons de produits alimentaires sont prélevés conformément aux documents réglementaires en vigueur (GOST 18963-73. Eau potable. Méthodes d'analyse sanitaire et bactériologique. M., 1986 ; GOST 9958-81. Produits de charcuterie et produits carnés. M., 1982 ; GOST 7702.2.1-95. Viande, abats et produits semi-finis de volaille. M., 1994).
Pour préparer une suspension, un échantillon de produits alimentaires est placé dans un flacon stérile (verre) d'un homogénéisateur et une solution de chlorure de sodium à 0,85% est ajoutée en quantité quadruple. L'homogénéisation est réalisée au batteur électrique. Tout d'abord, le matériau est broyé en morceaux à une vitesse de rotation lente des couteaux, puis à 15 000-20 000 tr/min pendant 2,5 minutes. En l'absence d'homogénéisateur, il est permis de préparer la suspension d'essai dans un mortier de porcelaine stérile en broyant 20 g de produit avec 2-3 g de sable stérile, en ajoutant progressivement 80 cm de solution saline stérile. Pour l'inoculation sur milieu nutritif, une suspension est prélevée à l'aide d'une pipette graduée stérile après 15 minutes d'exposition à température ambiante. 1 ml de suspension contient 0,2 g de produit.
La gélose viande-peptone est versée dans des boîtes de Pétri en verre ou en plastique (9 cm de diamètre) et une fois la gélose refroidie, 5 à 6 filtres à membrane sont placés sur sa surface avec une pince à épiler stérile. Le diagramme montre les principales étapes de détermination du nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs à l'aide de la méthode proposée.
Une solution physiologique à 0,6-0,8 % de MPA semi-liquide est versée dans 9 cm 3 dans des tubes à essai stériles. Ensuite, des dilutions décimales de la suspension étudiée sont préparées dans 9 cm 3 de solution physiologique de MPA semi-liquide. Pour cela, ajoutez 1 cm 3 de suspension à essai dans le premier tube à essai avec 9 cm 3 de gélose semi-liquide ; du premier tube à essai en mélangeant soigneusement 1 cm 3 de suspension à essai, transférez-le dans le second, etc. . 0,1 ml (1 goutte) de la culture diluée est appliqué sur une membrane filtrante située sur le MPA dans la boîte. Vous pouvez placer 5 à 6 gouttes d’agar avec différentes dilutions de culture dans une tasse. Les gouttes d'agar avec une culture diluée se solidifient en 10 à 15 minutes. Ensuite, les boîtes de Pétri sont cultivées tête en bas dans un thermostat à 37°C pendant 48 heures. Pour déterminer le nombre de cellules bactériennes viables, les colonies sont comptées dans des gouttes de gélose.
Pour déterminer le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs, le nombre de colonies cultivées est multiplié par le degré de dilution de la culture à l'aide de la formule :
où x est le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs,
a est le nombre de colonies cultivées,
n est le degré de dilution.
Pour quantifier la teneur en micro-organismes qui donnent une croissance confluente et forment de très petites colonies (ressemblant à de la rosée), ainsi que pour étudier les processus intrapopulations en utilisant la microscopie optique, les colonies cultivées sur des filtres à membrane sont fixées dans de la vapeur de glutaraldéhyde à 25 % pendant 30 à 40 minutes. Le filtre à membrane est ensuite placé sur la surface d'une lame de verre et quelques gouttes d'oxyde de propylène y sont appliquées. Le filtre à membrane devient transparent et même les très petites colonies (de couleur rosée) peuvent être comptées au microscope ou à la loupe et, si nécessaire, une microphotographie peut être prise.
La méthode est expliquée ci-dessous exemples spécifiques mise en œuvre (voir tableau).
Légende : méthode 1 - l'analogue le plus proche
méthode 2 - suggérée
Exemple 1. Détermination du nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs dans la saucisse bouillie. La détermination du nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs a été réalisée de deux manières : méthode 1 (prototype) - Pour réaliser l'analyse, de la gélose viande-peptone est coulée dans des boîtes de Pétri en verre ou en plastique (diamètre 9 cm). L'échantillonnage des produits alimentaires a été effectué conformément aux documents réglementaires en vigueur (GOST 9958-81. Saucisses et produits carnés. M., 1982). Pour préparer la suspension, un échantillon de produits alimentaires a été placé dans un flacon stérile (verre) d'un homogénéisateur et une solution de chlorure de sodium à 0,85 % a été ajoutée en quantité quadruple. L'homogénéisation a été réalisée au batteur électrique. Tout d'abord, le matériau a été broyé en morceaux à une vitesse de rotation lente des couteaux, puis à 15 000-20 000 tr/min pendant 2,5 minutes. Pour l'inoculation sur milieu nutritif, une suspension a été prélevée avec une pipette graduée stérile après 15 min d'exposition à température ambiante. 1 ml de suspension contient 0,2 g de produit. On a préparé 3 dilutions de la suspension à tester dans une solution physiologique de chlorure de sodium : une solution physiologique de chlorure de sodium est versée par 9 cm 3 dans des éprouvettes stériles. Ensuite, des dilutions décimales de la suspension étudiée sont préparées dans 9 cm 3 de solution physiologique de chlorure de sodium. Pour ce faire, ajoutez 1 cm 3 de suspension à essai dans le premier tube à essai avec 9 cm 3 de chlorure de sodium ; du premier tube à essai en mélangeant soigneusement 1 cm 3 de suspension à essai, transférez-le dans le second, etc. puis 0,1 ml de chaque dilution a été appliqué dans une boîte de Pétri (3 boîtes au total). Ensuite, les boîtes de Pétri ont été cultivées à l'envers dans un thermostat à 37°C pendant 48 heures. Pour déterminer le nombre de cellules bactériennes viables, les colonies ont été comptées dans des gouttes de gélose. Pour déterminer le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs, le nombre de colonies cultivées a été multiplié par le degré de dilution de la culture à l'aide de la formule :
où x est le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs,
a est le nombre de colonies cultivées,
n - degré de dilution,
La méthode 2 (proposée) comprend la préparation d'une solution à diluer (solution physiologique à 0,6-0,8 % de MPA semi-liquide, solution physiologique à 0,6-0,8 % de MPA semi-liquide) et une gélose viande-peptone pour l'inoculation ; effectuer une analyse; comptabilisation des résultats.
Pour réaliser l'analyse, la gélose viande-peptone est versée dans des boîtes de Pétri en verre ou en plastique (9 cm de diamètre), après refroidissement de la gélose, jusqu'à 6 filtres à membrane sont placés sur sa surface avec une pince à épiler stérile. L'échantillonnage des produits alimentaires a été effectué conformément aux documents réglementaires en vigueur (GOST 9958-81. Saucisses et produits carnés. M., 1982). Pour préparer la suspension, un échantillon de produits alimentaires a été placé dans un flacon stérile (verre) d'un homogénéisateur et une solution de chlorure de sodium à 0,85 % a été ajoutée en quantité quadruple. L'homogénéisation a été réalisée au batteur électrique. Tout d'abord, le matériau a été broyé en morceaux à une vitesse de rotation lente des couteaux, puis à 15 000-20 000 tr/min pendant 2,5 minutes. Pour l'inoculation sur milieu nutritif, une suspension a été prélevée avec une pipette graduée stérile après 15 min d'exposition à température ambiante. 1 ml de suspension contient 0,2 g de produit. Trois dilutions de la suspension testée ont été préparées dans une solution physiologique de MPA : une solution physiologique à 0,6-0,8 % de MPA semi-liquide est versée dans des portions de 9 cm 3 d'éprouvettes stériles. Ensuite, des dilutions décimales de la suspension étudiée sont préparées dans 9 cm 3 de solution physiologique de MPA semi-liquide. Pour cela, ajoutez 1 cm 3 de suspension à essai dans le premier tube à essai avec 9 cm 3 de gélose semi-liquide ; du premier tube à essai en mélangeant soigneusement 1 cm 3 de suspension à essai, transférez-le dans le second, etc. . puis 0,1 ml de chaque dilution a été appliqué à la surface d'une membrane filtrante située sur le MPA dans une boîte de Pétri. De plus, 3 dilutions ont été placées dans une boîte de Pétri. Ensuite, les boîtes de Pétri ont été cultivées à l'envers dans un thermostat à 37°C pendant 48 heures. Pour déterminer le nombre de cellules bactériennes viables, les colonies ont été comptées dans des gouttes de gélose. Pour déterminer le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs, le nombre de colonies cultivées a été multiplié par le degré de dilution de la culture à l'aide de la formule :
où x est le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs,
a est le nombre de colonies cultivées,
n est le degré de dilution.
Le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs déterminé par la méthode 1 - (9×10 2) et par la méthode 2 - (10×10 2) ne différait pas de manière significative.
Exemple 2. Détermination du nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs dans la viande. La détermination du nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs a été réalisée de deux manières : méthode 1 (prototype) - Pour réaliser l'analyse, de la gélose viande-peptone est coulée dans des boîtes de Pétri en verre ou en plastique (diamètre 9 cm). L'échantillonnage des produits alimentaires a été effectué conformément aux documents réglementaires en vigueur (GOST 9958-81. Saucisses et produits carnés. M., 1982). Pour préparer la suspension, un échantillon de produits alimentaires a été placé dans un flacon stérile (verre) d'un homogénéisateur et une solution de chlorure de sodium à 0,85 % a été ajoutée en quantité quadruple. L'homogénéisation a été réalisée au batteur électrique. Tout d'abord, le matériau a été broyé en morceaux à une vitesse de rotation lente des couteaux, puis à 15 000-20 000 tr/min pendant 2,5 minutes. Pour l'inoculation sur milieu nutritif, une suspension a été prélevée avec une pipette graduée stérile après 15 min d'exposition à température ambiante. 1 ml de suspension contient 0,2 g de produit. 6 dilutions de la suspension à tester ont été préparées dans une solution physiologique de chlorure de sodium : la solution physiologique de chlorure de sodium est versée par 9 cm 3 dans des éprouvettes stériles. Ensuite, des dilutions décimales de la suspension étudiée sont préparées dans 9 cm 3 de solution physiologique de chlorure de sodium. Pour ce faire, ajoutez 1 cm 3 de suspension à essai dans le premier tube à essai avec 9 cm 3 de chlorure de sodium ; du premier tube à essai en mélangeant soigneusement 1 cm 3 de suspension à essai, transférez-le dans le second, etc. puis 0,1 ml de chaque dilution a été appliqué dans une boîte de Pétri (6 boîtes au total). Ensuite, les boîtes de Pétri ont été cultivées à l'envers dans un thermostat à 37°C pendant 48 heures. Pour déterminer le nombre de cellules bactériennes viables, les colonies ont été comptées dans des gouttes de gélose. Pour déterminer le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs, le nombre de colonies cultivées a été multiplié par le degré de dilution de la culture à l'aide de la formule :
où x est le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs,
a est le nombre de colonies cultivées,
n est le degré de dilution.
Méthode 2 (proposée), comprenant la préparation d'une solution pour dilution (solution physiologique à 0,6-0,8 % de MPA semi-liquide et 0,6-0,8 % de solution physiologique de MPA semi-liquide) et d'une gélose viande-peptone pour l'inoculation ; effectuer une analyse; comptabilisation des résultats.
Pour effectuer l'analyse, la gélose viande-peptone est versée dans des boîtes de Petri en verre ou en plastique (9 cm de diamètre), et une fois la gélose refroidie, 5 à 6 filtres à membrane sont placés sur sa surface avec une pince à épiler stérile. L'échantillonnage des produits alimentaires a été effectué conformément aux documents réglementaires en vigueur (GOST 9958-81. Saucisses et produits carnés. M., 1982). Pour préparer la suspension, un échantillon de produits alimentaires a été placé dans un flacon stérile (verre) d'un homogénéisateur et une solution de chlorure de sodium à 0,85 % a été ajoutée en quantité quadruple. L'homogénéisation a été réalisée au batteur électrique. Tout d'abord, le matériau a été broyé en morceaux à une vitesse de rotation lente des couteaux, puis à 15 000-20 000 tr/min pendant 2,5 minutes. Pour l'inoculation sur milieu nutritif, une suspension a été prélevée avec une pipette graduée stérile après 15 min d'exposition à température ambiante. 1 ml de suspension contient 0,2 g de produit. 6 dilutions de la suspension à tester ont été préparées dans une solution physiologique de MPA : 0,6-0,8 % de solution physiologique de MPA semi-liquide est versée dans 9 cm 3 dans des tubes à essai stériles. Ensuite, des dilutions décimales de la suspension étudiée sont préparées dans 9 cm 3 de solution physiologique de MPA semi-liquide. Pour cela, ajoutez 1 cm 3 de suspension à essai dans le premier tube à essai avec 9 cm 3 de gélose semi-liquide ; du premier tube à essai en mélangeant soigneusement 1 cm 3 de suspension à essai, transférez-le dans le second, etc. . puis 0,1 ml de chaque dilution a été appliqué à la surface d'une membrane filtrante située sur le MPA dans une boîte de Pétri. De plus, 6 dilutions ont été placées dans deux boîtes de Pétri. Ensuite, les boîtes de Pétri ont été cultivées à l'envers dans un thermostat à 37°C pendant 48 heures. Pour déterminer le nombre de cellules bactériennes viables, les colonies ont été comptées dans des gouttes de gélose. Pour déterminer le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs, le nombre de colonies cultivées a été multiplié par le degré de dilution de la culture à l'aide de la formule :
où x est le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs,
a est le nombre de colonies cultivées,
n est le degré de dilution.
Après culture dans des boîtes de Pétri à 37°C pendant 48 heures, le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs déterminé par la méthode 1 - (8 × 10 5) et par la méthode 2 - (7 × 10 5) ne différait pas significativement.
D'après les exemples donnés, il ressort clairement que lors d'une évaluation comparative des deux méthodes, le nombre d'UFC déterminé par la méthode proposée ne différait pas de manière significative de celui déterminé par la méthode généralement acceptée. Dans le même temps, la méthode développée présente de nombreux avantages. Ainsi, il fallait : selon l'existant - 98 minutes pour déterminer le nombre de cellules viables pour cinq types d'échantillons ; selon la méthode proposée - 48 min. La consommation du milieu nutritif était selon le prototype - 420 ml ; selon la méthode proposée - 135 ml. Le nombre de boîtes de Petri selon le prototype était de 28 pièces ; selon la méthode proposée - 9 pièces.
Le développement dynamique de l'économie de l'industrie alimentaire est impossible sans accroître la compétitivité des biens et services. Le facteur déterminant pour les consommateurs est la qualité du produit. Les fabricants doivent connaître et étudier les exigences de qualité des biens qu'ils produisent, être capables d'analyser et d'évaluer quantitativement et qualitativement leurs performances.
Dans la documentation réglementaire et technique, les indicateurs de qualité contrôlés sont répartis en 3 groupes : organoleptiques, physico-chimiques et microbiologiques.
Les méthodes de recherche microbiologique déterminent le degré de contamination d'un produit par des micro-organismes et permettent d'identifier les changements à venir dans la qualité du produit et sa détérioration.
QMAFAnM (nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs) est le test de sécurité microbienne le plus courant. Cet indicateur utilisé partout pour évaluer la qualité des produits, à l'exception de ceux dans la production desquels des cultures microbiennes spéciales sont utilisées (par exemple, la bière, le kvas, les produits laitiers et ainsi de suite.). La composition de QMAFAnM comprend divers groupes taxonomiques de micro-organismes - bactéries, levures, moules. Leur nombre total indique l'état sanitaire et hygiénique du produit et le degré de contamination par la microflore.
Les produits contenant un grand nombre de bactéries, même non pathogènes et ne modifiant pas leurs caractéristiques organoleptiques, ne peuvent être considérés comme complets. Une teneur importante en cellules bactériennes viables dans les produits alimentaires (à l'exception de ceux dans la production desquels des levains sont utilisés) indique soit une efficacité insuffisante traitement thermique matières premières, ou un mauvais nettoyage des équipements, ou des conditions de stockage insatisfaisantes du produit. Une contamination bactérienne accrue du produit indique également sa possible détérioration.
Pour le consommateur, l'indicateur QMAFAnM caractérise la qualité, la fraîcheur et la sécurité des produits alimentaires. Dans le même temps, évaluer la qualité d'un produit uniquement par cet indicateur présente un certain nombre d'inconvénients. Premièrement, il ne s'agit que d'une évaluation générale et quantitative des micro-organismes, puisque l'étude ne prend pas en compte les micro-organismes pathogènes, conditionnellement pathogènes, psychrophiles et thermophiles. Deuxièmement, la méthode est inacceptable pour les produits contenant une microflore technologique et spécifique.
L'indicateur KMAFAnM permet d'évaluer le niveau des conditions sanitaires et hygiéniques dans la sphère sociale de la production, il permet d'identifier les violations des régimes de stockage et de transport des produits.
Dans 1 échantillon de bière légère non pasteurisée, des coliformes ont été détectés ;
- dans 1 échantillon de poisson x\c - excès de QMAFAnM;
- dans 3 échantillons d'air de chambre de réfrigération- un excès d'UFC de moisissures a été détecté - évaluation sanitaire « mauvaise » ;
- dans 4 échantillons de poisson séché, un excès d'UFC de moisissures a été détecté ;
- dans 4 échantillons de poisson séché, un excès de QMAFAnM a été détecté ;
- en 5 échantillons boire de l'eau(Eau artésienne mise en bouteille via un réseau de machines automatiques pour remplir l'eau dans des récipients de consommation) – dépassant le TMC.
La détermination du nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs (QMAFAnM ou nombre microbien total, TMC) fait référence à l'évaluation du nombre d'un groupe de micro-organismes indicatifs sanitaires. La composition de QMAFAnM comprend divers groupes taxonomiques de micro-organismes - bactéries, levures, moisissures. Leur nombre total indique l'état sanitaire et hygiénique du produit et le degré de contamination par la microflore. Température optimale pour la croissance KMAFAnM 35-37оС (dans des conditions aérobies) ; la limite de température de leur croissance se situe entre 20 et 45°C. Les micro-organismes mésophiles vivent dans le corps des animaux à sang chaud et survivent également dans le sol, l'eau et l'air. L'indicateur QMAFAnM caractérise la teneur totale en micro-organismes du produit. Son contrôle est sur tout le monde étapes technologiques vous permet de surveiller dans quelle mesure les matières premières entrent dans la production, comment leur degré de « pureté » change après le traitement thermique et si le produit subit une recontamination après le traitement thermique, pendant l'emballage et le stockage. L'indicateur QMAFAnM est évalué par le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs cultivés sous forme de colonies visibles sur un milieu nutritif solide après incubation à 37°C pendant 24 à 48 heures.
QMAFAnM est le test de sécurité microbienne le plus courant. Cet indicateur est utilisé partout pour évaluer la qualité des produits, à l'exception de ceux dans la fabrication desquels des cultures microbiennes spéciales sont utilisées (par exemple, la bière, le kvas, les produits laitiers fermentés, etc.). La valeur de l’indicateur QMAFAnM dépend de nombreux facteurs. Les plus importants sont le mode de traitement thermique du produit, régime de température pendant son transport, son stockage et sa vente, l'humidité du produit et humidité relative air, présence d'oxygène, acidité du produit, etc. Une augmentation de QMAFAnM indique la prolifération de micro-organismes, qui peuvent inclure des agents pathogènes et des micro-organismes causant des dommages produit (par exemple, moisissure).
Bien que le nombre total de bactéries QMAFAnM ne puisse pas indiquer directement la présence ou l'absence de bactéries pathogènes dans les produits alimentaires, cet indicateur est assez largement utilisé, par exemple dans l'industrie laitière. L'indicateur KMAFAnM (OMCH) caractérise les régimes sanitaires et hygiéniques de production et les conditions de stockage des produits laitiers. Les produits contenant un grand nombre de bactéries, même non pathogènes et ne modifiant pas leurs caractéristiques organoleptiques, ne peuvent être considérés comme complets. Une teneur importante en cellules bactériennes viables dans les produits alimentaires (à l'exception de ceux dans la production desquels des levains sont utilisés) indique soit un traitement thermique insuffisant des matières premières, soit un mauvais nettoyage des équipements, soit des conditions de stockage insatisfaisantes du produit. Une contamination bactérienne accrue du produit indique également sa possible détérioration.
Pour le consommateur, l'indicateur KMAFAnM (OMC) caractérise la qualité, la fraîcheur et la sécurité des produits alimentaires. Dans le même temps, évaluer la qualité d'un produit uniquement par cet indicateur présente un certain nombre d'inconvénients. Premièrement, il ne s'agit que d'une évaluation générale et quantitative des micro-organismes, puisque l'étude ne prend pas en compte les micro-organismes pathogènes, conditionnellement pathogènes, psychrophiles et thermophiles. Deuxièmement, la méthode est inacceptable pour les produits contenant une microflore technologique et spécifique.
L'indicateur KMAFAnM permet également d'évaluer le niveau des conditions sanitaires et hygiéniques dans la sphère sociale en production, il permet d'identifier les violations des régimes de stockage et de transport du produit.
Nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs (QMAFAnM)
La détermination du nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs (QMAFAnM ou nombre microbien total, TMC) fait référence à l'évaluation du nombre d'un groupe de micro-organismes indicatifs sanitaires. La composition de QMAFAnM comprend divers groupes taxonomiques de micro-organismes - bactéries, levures, moisissures. Leur nombre total indique l'état sanitaire et hygiénique du produit et le degré de contamination par la microflore. La température optimale pour la croissance de KMAFAnM est de 35 à 37 °C (dans des conditions aérobies) ; la limite de température de leur croissance se situe entre 20 et 45 ° C. Les micro-organismes mésophiles vivent dans le corps des animaux à sang chaud et survivent également dans le sol, l'eau et l'air.
L'indicateur QMAFAnM caractérise la teneur totale en micro-organismes du produit. Son contrôle à toutes les étapes technologiques permet de contrôler dans quelle mesure les matières premières sont « propres » à la production, comment évolue le degré de leur « pureté » après traitement thermique, et si le produit subit une recontamination après traitement thermique, lors du conditionnement. et le stockage. L'indicateur QMAFAnM est évalué par le nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs cultivés sous forme de colonies visibles sur un milieu nutritif solide après incubation à 37°C pendant 24-48 heures.
QMAFAnM est le test de sécurité microbienne le plus courant. Cet indicateur est utilisé partout pour évaluer la qualité des produits, à l'exception de ceux dans la fabrication desquels des cultures microbiennes spéciales sont utilisées (par exemple, la bière, le kvas, les produits laitiers fermentés, etc.). La valeur de l’indicateur QMAFAnM dépend de nombreux facteurs. Les plus importants sont le régime de traitement thermique du produit, le régime de température lors de son transport, stockage et vente, l'humidité du produit et l'humidité relative de l'air, la présence d'oxygène, l'acidité du produit, etc. Une augmentation de QMAFAnM indique la prolifération de micro-organismes, qui peuvent inclure des agents pathogènes et des micro-organismes responsables de la détérioration du produit (par exemple, des moisissures).
Bien que le nombre total de bactéries QMAFAnM ne puisse pas indiquer directement la présence ou l'absence de bactéries pathogènes dans les produits alimentaires, cet indicateur est assez largement utilisé, par exemple dans l'industrie laitière. L'indicateur KMAFAnM (OMCH) caractérise les régimes sanitaires et hygiéniques de production et les conditions de stockage des produits laitiers. Les produits contenant un grand nombre de bactéries, même non pathogènes et ne modifiant pas leurs caractéristiques organoleptiques, ne peuvent être considérés comme complets. Une teneur importante en cellules bactériennes viables dans les produits alimentaires (à l'exception de ceux dans la production desquels des levains sont utilisés) indique soit un traitement thermique insuffisant des matières premières, soit un mauvais nettoyage des équipements, soit des conditions de stockage insatisfaisantes du produit. Une contamination bactérienne accrue du produit indique également sa possible détérioration.
Pour le consommateur, l'indicateur KMAFAnM (OMC) caractérise la qualité, la fraîcheur et la sécurité des produits alimentaires. Dans le même temps, évaluer la qualité d'un produit uniquement par cet indicateur présente un certain nombre d'inconvénients. Premièrement, il ne s'agit que d'une évaluation générale et quantitative des micro-organismes, puisque l'étude ne prend pas en compte les micro-organismes pathogènes, conditionnellement pathogènes, psychrophiles et thermophiles. Deuxièmement, la méthode est inacceptable pour les produits contenant une microflore technologique et spécifique.
L'indicateur KMAFAnM permet également d'évaluer le niveau des conditions sanitaires et hygiéniques dans la sphère sociale en production, il permet d'identifier les violations des régimes de stockage et de transport du produit.
Méthodes de détection
Méthode classique
La méthode de dosage de QMAFAnM par inoculation dans des milieux nutritifs gélosés repose sur l'inoculation du produit ou sa dilution dans milieu nutritif, incubant les cultures et comptant toutes les colonies cultivées.
Il existe également une méthode pour déterminer le MPN (numéro le plus probable) QMAFAnM. Elle consiste à semer le produit et/ou à diluer un échantillon du produit dans un milieu nutritif liquide, à incuber les cultures en tenant compte des signes visibles de croissance de micro-organismes, à réensemencer (si nécessaire) le liquide de culture sur un milieu nutritif gélosé pour confirmer la croissance des micro-organismes et compter leur nombre à l'aide du tableau NHF.
Méthodes alternatives (accélérées)
Pour une détermination accélérée de QMAFAnM dans l'échantillon de test, il est recommandé d'utiliser la plaque de comptage aérobie (AC) 3M TM Petrifilm. Petrifilm 3M TM Petrifilm Aerobic Count Plate (AC) contient un milieu nutritif prêt à l'emploi, un gel (durcissant à température ambiante) et un indicateur de tétrazolium, qui facilite le comptage des colonies sur Petrifilm.
Règlements
Codex Alimentarius. Hygiène alimentaire. Textes de base. Normes et réglementations techniques internationales recommandées. Principes généraux hygiène alimentaire. 2003.
caractéristiques générales produit alimentaire par KMAFAnM
|
Groupe contamination microbienne |
UFC/g (cm 3) |
État du produit |
|
10 3 ÷ 10 4 , ≤ 10 5 |
Frais, de bonne qualité, de longue conservation |
|
|
> 10 5 ÷ 10 6 |
Fabriqué ou stocké en violation des conditions technologiques ou sanitaires et hygiéniques |
|
|
> 10 6 ÷ 10 7 |
Potentiellement dangereux en tant que source de micro-organismes pathogènes et de leurs toxines |
|
|
> 10 7 ÷ 10 8 |
Gâté, comme confirmé visuellement (changement de couleur, odeur, moisissure) |
Paramètres microbiologiques approximatifs de certains produits
Le lait et les produits laitiers sont produits de valeur aliments d'origine animale. Cependant, il ne faut pas oublier que le lait provenant d'animaux malades peut être une source d'infection humaine par des maladies zooanthroponotiques (communes à l'homme et aux animaux), en outre, si règles sanitaires et les technologies de production, de transformation et de stockage, le lait peut provoquer une toxicose alimentaire et des infections toxiques.
La source de contamination primaire des produits laitiers par des micro-organismes est le lait cru. Les microbes pénètrent dans le lait depuis l'environnement extérieur par les canaux excréteurs, le réservoir à lait et le canal du mamelon. La microflore non spécifique du lait est constituée de bactéries, de levures et de moisissures. La contamination du lait par des micro-organismes se produit déjà pendant le processus de traite et son intensité dépend du niveau d'hygiène de l'exploitation, de la qualité du lavage et de la désinfection du matériel de traite. Les microbes se trouvent en grand nombre à la surface de la peau de l'animal. Les microbes arrivent à la surface de la peau à partir de la nourriture, de la litière, du fumier et de l'air.
Les mauvaises conditions de stockage du lait contribuent également à la croissance de la microflore. Le lait frais fraîchement traite est bactéricide, c'est-à-dire la capacité de retarder la prolifération des bactéries pénétrant dans le lait et même de les tuer. Pour conserver les propriétés bactéricides lait frais, il est refroidi. À une température de +30°C, l'activité bactéricide persiste pendant 3 heures, à +15°C - environ 8 heures, à +10°C - environ 24 heures. Le lait est refroidi immédiatement après la traite et conservé à une température de +2 à +6°C jusqu'à son expédition. Disparaît pendant le stockage propriétés antimicrobiennes le lait, et si les règles de stockage ne sont pas respectées, des conditions sont créées pour le développement d'une microflore indésirable, ce qui entraîne la détérioration du produit.
Des micro-organismes pathogènes peuvent pénétrer dans le lait pendant sa production et son transport depuis environnement ou peut être contenu dans le lait d'animaux malades. Il existe surtout de nombreux microbes différents dans le lait des animaux atteints de mammite (staphylocoques, streptocoques, etc.). Les micro-organismes peuvent pénétrer dans le lait par voie aérienne et par contact avec des animaux atteints de tuberculose, de salmonellose, etc. Ainsi, avec les protéines, les matières grasses et l’acidité, la teneur en bactéries (ou QMAFAnM) est l’un des indicateurs les plus importants de la qualité et de la sécurité du lait.
Un bon lait a donc une faible teneur en bactéries. Cependant, il ne faut pas oublier que le lait cru ne peut avoir aucune contamination bactérienne. Le lait est un produit vivant obtenu à partir d'animaux et les bactéries sont des compagnons essentiels de tout organisme vivant et, par conséquent, les produits de son activité vitale. Un lait contenant un grand nombre de bactéries, même non pathogènes et ne modifiant pas les caractéristiques organoleptiques, ne peut être considéré comme complet. Une contamination bactérienne accrue du produit indique la prolifération de micro-organismes, qui peuvent inclure des micro-organismes pathogènes qui provoquent la détérioration du produit. Contenu élevé les micro-organismes peuvent également causer intoxication alimentaire avec des signes de diarrhée et de gastro-entérite.
Des exigences pour le lait cru concernant la contamination bactérienne ont été établies documents réglementaires RF et Règlements techniques de l'Union douanière. Teneur bactérienne du lait - teneur quantitative en bactéries dans 1 cm³ lait cru. Les indicateurs microbiologiques du lait selon TMC (nombre total de microbes) ou QMAFAnM (nombre de micro-organismes mésophiles aérobies et anaérobies facultatifs) doivent être conformes aux exigences du Règlement technique de l'Union douanière « Sur la sécurité du lait et des produits laitiers » (TR CU 033/2013) du 10/09/2013 et ne doit pas dépasser 5,0×10 5 (500 000) CFU/cm³.
La contamination bactérienne du lait préparé est déterminée à l'aide d'un test à la réductase. La méthode est basée sur le fait que l'enzyme réductase sécrétée par la microflore du lait décolore le méthylène. Colorant bleu. Un lien a été établi entre la quantité de microflore et le taux de décoloration du lait auquel est ajouté du bleu de méthylène. Plus le taux de décoloration est élevé, plus grande quantité des micro-organismes sont présents dans le lait et, par conséquent, sa qualité est moins bonne.
 Dans les laboratoires d'essais conformément à GOST 32901-2014 « Lait et produits laitiers. Méthodes d'analyse microbiologique", pour déterminer la contamination bactérienne du lait cru, la méthode standard sur plaque d'inoculation de certaines dilutions du lait d'origine sur un milieu nutritif solide est utilisée comme méthode d'arbitrage, suivie d'une culture pendant 72 heures à 30 ± 1° C et comptage des unités formant colonies (UFC) de micro-organismes mésophiles aérobies et anaérobies facultatifs (QMAFAnM).
Dans les laboratoires d'essais conformément à GOST 32901-2014 « Lait et produits laitiers. Méthodes d'analyse microbiologique", pour déterminer la contamination bactérienne du lait cru, la méthode standard sur plaque d'inoculation de certaines dilutions du lait d'origine sur un milieu nutritif solide est utilisée comme méthode d'arbitrage, suivie d'une culture pendant 72 heures à 30 ± 1° C et comptage des unités formant colonies (UFC) de micro-organismes mésophiles aérobies et anaérobies facultatifs (QMAFAnM).
Ainsi, QMAFAnM définition dans le lait indique l'état sanitaire et hygiénique du produit, le degré de sa contamination par la microflore, permet de juger de l'état de santé de l'animal, de l'état de la mamelle, de l'efficacité du lavage et de la désinfection du matériel, du respect des règles sanitaires et conditions d'hygiène de production et règles d'hygiène personnelle des travailleurs, conditions de stockage et de transport produits finis. Cet indicateur est donc standardisé pour tous les produits laitiers à l'exception des produits fabriqués à partir de la microflore techniquement utile (microflore des levains).
Les cellules somatiques sont des composants permanents du lait et sont représentées par : les cellules épithéliales de la membrane muqueuse des glandes mammaires, les alvéoles et les petits canaux galactophores, qui sont de grandes cellules rondes (taille de 12 à 100 microns ou plus) généralement sous forme de groupes ou en couches, moins souvent sous forme de cellules uniques ; cellules épithéliales dégénérées d'une forme indéterminée de structure détruite ; éléments formés du sang : leucocytes (principalement lymphocytes, neutrophiles, éosinophiles, etc.) et érythrocytes. On sait que les cellules somatiques du lait trait ne se multiplient pas (contrairement aux bactéries).
La composition morphologique et cytologique ainsi que la teneur quantitative en cellules somatiques du lait de chaque animal varient fortement en fonction de divers facteurs : l'âge de l'animal (il y a moins de cellules somatiques dans le lait des génisses primipares que chez les vaches avec un grand nombre de lactations), la période de lactation (dans le lait d'une vache en bonne santé quantité minimale les cellules somatiques sont observées pendant 2 à 6 mois. lactation, et augmenté - pendant la période du colostrum, à la fin de la lactation et pendant la période de démarrage), la race et caractéristiques individuelles animal, ainsi que l'état de santé des animaux (notamment l'état de la mamelle), le niveau et les modes d'alimentation, etc.
Le contenu des cellules somatiques est indicateur important la sécurité du lait et montre son aptitude à la transformation. Présence dans le lait grande quantité cellules somatiques entraîne une diminution importante de sa indicateurs de qualité: l'utilité biologique est perdue, les propriétés technologiques se détériorent lors de la transformation. De plus, l'acidité du lait diminue et des pertes de graisse, de caséine et de lactose sont constatées. Le lait devient moins résistant à la chaleur et caille pire présure, le développement d'utiles bactéries lactiques. Il est impossible de faire avec un tel lait produits de qualité(fromage, fromage blanc, yaourt, kéfir, etc.). Les cellules somatiques affectent non seulement la qualité du lait, mais aussi la productivité des vaches.
À partir du 1er juillet 2017, la teneur en cellules somatiques du lait cru ne doit pas dépasser 7,5 × 10 5 pour 1 cm3, tandis que pour le lait cru destiné à la production nourriture pour bébés, fromages et lait stérilisé - pas plus de 5 × 10 5 cellules pour 1 cm3.
Il est très important que la teneur en cellules somatiques du lait puisse être déterminée facilement et rapidement. Pour détecter les impuretés du lait de mammite dans les matières premières préparées, des méthodes directes et indirectes sont utilisées, basées sur la détermination du nombre de cellules somatiques. Les méthodes indirectes pour déterminer le nombre de cellules somatiques dans le lait comprennent des méthodes pour leur détection par interaction avec un certain nombre de réactifs. Actuellement, la détermination du nombre de cellules somatiques dans le lait est réglementée par GOST 23453-2014 « Lait cru. Méthodes de détermination des cellules somatiques" et est réalisée à l'aide de médicaments de diagnostic tels que "Mastoprim" visuellement et à l'aide d'un viscosimètre. La norme a été élaborée par l'Institution scientifique d'État « VNIIMS Rosselkhozakademii ».
La méthode est basée sur l'effet du sulfanol (un tensioactif inclus dans le médicament "Mastoprim") sur la membrane cellulaire des cellules somatiques, entraînant une violation de son intégrité et la libération du contenu cellulaire dans l'environnement extérieur. Dans ce cas, la viscosité (consistance) change, ce qui est enregistré visuellement ou avec un viscosimètre. Pour l'analyse, des plaques PMK-1 sont utilisées, suivies d'une évaluation visuelle ou de viscosimètres de type capillaire, calibrés par le fabricant de l'appareil pour déterminer le nombre de cellules somatiques dans le lait cru.
L'évaluation visuelle est extrêmement simple, mais ne permet pas d'obtenir des indicateurs numériques précis du nombre de cellules somatiques dans le lait. À évaluation visuelle nous ne pouvons déterminer les limites de sécurité qu'en fonction des instructions des réactifs.
 Dans notre laboratoire, la teneur en cellules somatiques du lait est déterminée à l'aide d'un viscosimètre Somatos-V.2K. La procédure de détermination est la suivante : 5 ml d'une solution du médicament "Mastoprim" et 10 ml de lait cru analysé sont prélevés à l'aide de pipettes et ajoutés au flacon du viscosimètre. Avant le prélèvement, le lait cru à analyser doit être soigneusement mélangé et, si nécessaire, nettoyé des impuretés mécaniques. Le mélange du lait cru analysé avec une solution du médicament "Mastoprim" dans le flacon viscosimétrique est agité pendant (30 ± 10) s en mode manuel ou automatique. A la fin du mélange, le nombre de cellules somatiques dans le lait cru analysé est déterminé par le temps pendant lequel le mélange s'écoule du capillaire. La durée de la fuite est déterminée par la viscosité du mélange de lait cru avec une solution du médicament Mastoprim, qui est en corrélation avec la teneur initiale en cellules somatiques. La plage de détermination du nombre de cellules somatiques lors de l'utilisation de viscosimètres capillaires est de 90 à 1 500 000 dans 1 cm3 de lait cru et la durée d'écoulement du mélange du capillaire varie de 12 à 58 s.
Dans notre laboratoire, la teneur en cellules somatiques du lait est déterminée à l'aide d'un viscosimètre Somatos-V.2K. La procédure de détermination est la suivante : 5 ml d'une solution du médicament "Mastoprim" et 10 ml de lait cru analysé sont prélevés à l'aide de pipettes et ajoutés au flacon du viscosimètre. Avant le prélèvement, le lait cru à analyser doit être soigneusement mélangé et, si nécessaire, nettoyé des impuretés mécaniques. Le mélange du lait cru analysé avec une solution du médicament "Mastoprim" dans le flacon viscosimétrique est agité pendant (30 ± 10) s en mode manuel ou automatique. A la fin du mélange, le nombre de cellules somatiques dans le lait cru analysé est déterminé par le temps pendant lequel le mélange s'écoule du capillaire. La durée de la fuite est déterminée par la viscosité du mélange de lait cru avec une solution du médicament Mastoprim, qui est en corrélation avec la teneur initiale en cellules somatiques. La plage de détermination du nombre de cellules somatiques lors de l'utilisation de viscosimètres capillaires est de 90 à 1 500 000 dans 1 cm3 de lait cru et la durée d'écoulement du mélange du capillaire varie de 12 à 58 s.
Des lectures au viscosimètre inférieures à 90 000 dans 1 cm3 indiquent une falsification du lait cru comme produits chimiques, et par exposition à la température :
L'ajout de peroxyde d'hydrogène, d'urée, de soude et d'autres substances utilisées pour falsifier certains indicateurs du lait cru au lait entraîne une diminution directement proportionnelle des valeurs du viscosimètre en fonction de leur concentration ;
Tout chauffage du lait à des températures de thermisation ou de pasteurisation entraîne une défaillance des lectures de l'appareil, et le viscosimètre affiche des valeurs inférieures à 90 000 cellules pour 1 cm3 de lait, quel que soit leur véritable contenu.
Ces caractéristiques doivent être prises en compte lors de l'analyse des résultats obtenus.
Le contenu des cellules somatiques est le plus important indicateur indirect la santé de la mamelle, car au cours du processus inflammatoire du lait, le nombre de cellules sanguines, en particulier de leucocytes et de granulocytes neutrophiles, augmente fortement. Processus inflammatoires sont à l'origine du développement d'une mammite subclinique. Avec la mammite subclinique, aucun symptôme visible d'inflammation n'est détecté dans la mamelle, mais la teneur en cellules somatiques dans le lait augmente. Ainsi, les changements dans composition chimique le lait sont souvent la preuve de la présence de la même mammite. Les agents responsables les plus courants de la mammite subclinique sont les streptocoques et les staphylocoques. La mammite subclinique peut durer longtemps, provoquant préjudice permanentà la fois la santé de la mamelle et de l'exploitation (diminution de la productivité, baisse du prix du lait), et peut également évoluer vers une mammite clinique.
Il existe également d'autres facteurs qui affectent le contenu en cellules somatiques du lait, par exemple : erreurs lors de la traite, défauts du matériel de traite, hygiène insuffisante, erreurs d'entretien, erreurs d'alimentation, etc.
En conclusion, je voudrais présenter quelques chiffres : depuis le début de cette année, les laboratoires vétérinaires de la région ont examiné plus de 1 500 échantillons de matières premières lait de vache provenant d'élevages, dont seuls 7 échantillons ont dû être rejetés sur la base des indicateurs « QMAFAnM » et « Contenu en cellules somatiques ». Cela parle de bonne qualité lait vendu par les producteurs agricoles de notre région.