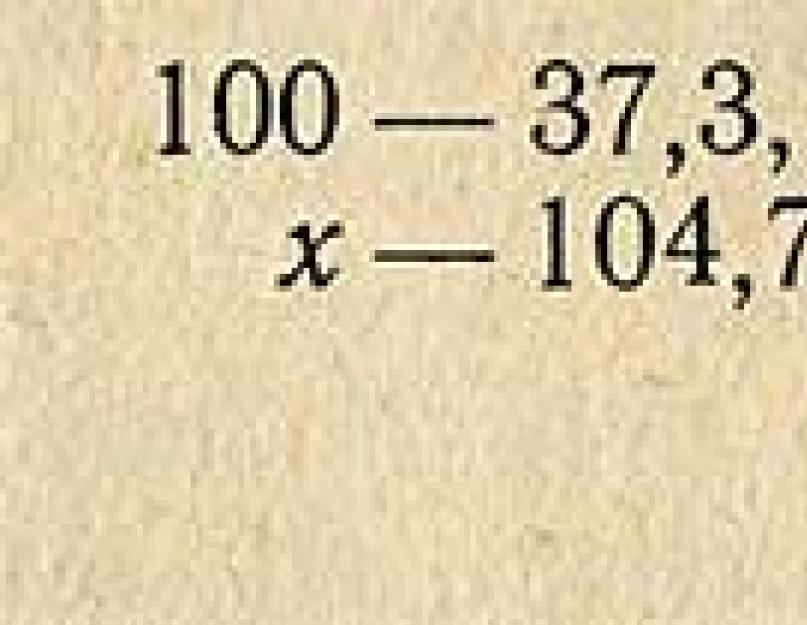Unités SI dans les diagnostics de laboratoire clinique.
Dans les diagnostics de laboratoire clinique, il est recommandé d'utiliser le Système international d'unités conformément aux règles suivantes.
1. L’unité de volume doit être le litre. Il n'est pas recommandé d'utiliser des sous-multiples ou des multiples d'un litre (1-100 ml) dans le dénominateur.
2. La concentration des substances mesurées est indiquée en molaire (mol/l) ou en masse (g/l).
3. La concentration molaire est utilisée pour les substances dont le poids moléculaire relatif est connu. La concentration ionique est exprimée en concentration molaire.
4. La concentration massique est utilisée pour les substances dont le poids moléculaire relatif est inconnu.
5. La densité est indiquée en g/l ; clairance – en ml/s.
6. L'activité enzymatique sur la quantité de substances en temps et en volume est exprimée en mol/(s*l) ; µmol/(s*l); nmol/(s*l).
Lors de la conversion d'unités de masse en unités de quantité d'une substance (molaire), le facteur de conversion est K=1/Mr, où Mr est la masse moléculaire relative. Dans ce cas, l’unité de masse initiale (gramme) correspond à l’unité molaire de la quantité de substance (mol).
Caractéristiques générales.
Les solutions sont des systèmes homogènes constitués de deux ou plusieurs composants et produits de leur interaction. Non seulement l'eau, mais aussi l'alcool éthylique, l'éther, le chloroforme, le benzène, etc. peuvent agir comme solvant.
Le processus de dissolution s'accompagne souvent d'un dégagement de chaleur (réaction exothermique - dissolution d'alcalis caustiques dans l'eau) ou d'une absorption de chaleur (réaction endothermique - dissolution de sels d'ammonium).
Les solutions liquides comprennent des solutions de solides dans des liquides (une solution de sel dans l'eau), des solutions de liquides dans des liquides (une solution d'alcool éthylique dans l'eau), des solutions de gaz dans des liquides (CO 2 dans l'eau).
Les solutions peuvent être non seulement liquides, mais aussi solides (verre, alliage d'argent et d'or), ainsi que gazeuses (air). Les solutions aqueuses sont les plus importantes et les plus courantes.
La solubilité est la propriété d'une substance de se dissoudre dans un solvant. En fonction de leur solubilité dans l'eau, toutes les substances sont divisées en 3 groupes : hautement solubles, légèrement solubles et pratiquement insolubles. La solubilité dépend principalement de la nature des substances. La solubilité est exprimée par le nombre de grammes d'une substance qui peut être dissoute au maximum dans 100 g de solvant ou de solution à une température donnée. Cette quantité est appelée coefficient de solubilité ou simplement solubilité de la substance.
Une solution dans laquelle, à une température et un volume donnés, aucune dissolution supplémentaire de la substance ne se produit, est dite saturée. Une telle solution est en équilibre avec un excès de soluté ; elle contient la quantité maximale de substance possible dans les conditions données. Si la concentration d’une solution n’atteint pas la concentration de saturation dans des conditions données, alors la solution est dite insaturée. Une solution sursaturée contient plus de substance qu'une solution saturée. Les solutions sursaturées sont très instables. Une simple agitation du récipient ou un contact avec des cristaux de la substance dissoute conduit à une cristallisation instantanée. Dans ce cas, la solution sursaturée se transforme en solution saturée.
La notion de « solutions saturées » doit être distinguée de la notion de « solutions sursaturées ». Une solution à forte teneur en soluté est dite concentrée. Les solutions saturées de différentes substances peuvent varier considérablement en concentration. Pour les substances très solubles (nitrite de potassium), les solutions saturées ont une concentration élevée ; Pour les substances peu solubles (sulfate de baryum), les solutions saturées ont une faible concentration en soluté.
Dans la grande majorité des cas, la solubilité d’une substance augmente avec l’augmentation de la température. Mais il existe des substances dont la solubilité augmente légèrement avec l'augmentation de la température (chlorure de sodium, chlorure d'aluminium) voire diminue.
La dépendance de la solubilité de diverses substances en fonction de la température est représentée graphiquement à l'aide de courbes de solubilité. La température est portée sur l'axe des abscisses et la solubilité est portée sur l'axe des ordonnées. Ainsi, il est possible de calculer la quantité de sel qui s'échappe de la solution en refroidissant. La libération de substances de la solution à mesure que la température diminue est appelée cristallisation et la substance est libérée sous sa forme pure.
Si la solution contient des impuretés, alors la solution sera insaturée par rapport à elles même lorsque la température diminue et les impuretés ne précipiteront pas. C’est la base de la méthode de purification des substances – la cristallisation.
Dans les solutions aqueuses, des composés plus ou moins forts de particules de soluté avec de l'eau se forment - des hydrates. Parfois, cette eau est si étroitement liée à la substance dissoute que lorsqu’elle est libérée, elle fait partie des cristaux.
Les substances cristallines contenant de l'eau sont appelées hydrates cristallins et l'eau elle-même est appelée eau de cristallisation. La composition des hydrates cristallins est exprimée par une formule indiquant le nombre de molécules d'eau par molécule de substance - CuSO 4 * 5H 2 O.
La concentration est le rapport entre la quantité de soluté et la quantité de solution ou de solvant. La concentration de la solution est exprimée en rapport poids et volume. Les pourcentages en poids indiquent la teneur en poids de la substance dans 100 g de solution (mais pas dans 100 ml de solution !).
Technique de préparation de solutions approximatives.
Pesez les substances nécessaires et le solvant dans des rapports tels que la quantité totale soit de 100 g. Si le solvant est de l'eau dont la densité est égale à l'unité, il n'est pas pesé, mais un volume égal à la masse est mesuré. Si le solvant est un liquide dont la densité n'est pas égale à l'unité, soit il est pesé, soit la quantité de solvant exprimée en grammes est divisée par l'indicateur de densité et le volume occupé par le liquide est calculé. La densité P est le rapport entre la masse corporelle et son volume.
La densité de l'eau à 4 0 C est prise comme unité de densité.
La densité relative D est le rapport entre la densité d'une substance donnée et la densité d'une autre substance. En pratique, ils déterminent le rapport entre la densité d'une substance donnée et la densité de l'eau, prise comme unité. Par exemple, si la densité relative d'une solution est de 2,05, alors 1 ml pèse 2,05 g.
Exemple. Quelle quantité de chlorure de carbone 4 faut-il prendre pour préparer 100 g de solution à 10 % de matière grasse ? Peser 10 g de graisse et 90 g de solvant CCl 4 ou, en mesurant le volume occupé par la quantité requise de CCl 4, diviser la masse (90 g) par la densité relative D = (1,59 g/ml).
V = (90 g) / (1,59 g/ml) = 56,6 ml.
Exemple. Comment préparer une solution à 5 % de sulfate de cuivre à partir d'hydrate cristallin de cette substance (calculée en sel anhydre) ? Le poids moléculaire du sulfate de cuivre est de 160 g, celui de l'hydrate cristallin est de 250 g.
250 – 160 X = (5*250) / 160 = 7,8 g
Par conséquent, vous devez prendre 7,8 g d'hydrate cristallin, 92,2 g d'eau. Si la solution est préparée sans conversion en sel anhydre, le calcul est simplifié. Pesez la quantité spécifiée de sel et ajoutez le solvant en quantité telle que le poids total de la solution soit de 100 g.
Les pourcentages de volume indiquent la quantité d'une substance (en ml) contenue dans 100 ml d'une solution ou d'un mélange de gaz. Par exemple, une solution d'alcool éthylique à 96 % contient 96 ml d'alcool absolu (anhydre) et 4 ml d'eau. Les pourcentages de volume sont utilisés lors du mélange de liquides mutuellement solubles et lors de la préparation de mélanges gazeux.
Rapports en pourcentage poids-volume (une manière conventionnelle d’exprimer la concentration). Indiquer la quantité pondérale de la substance contenue dans 100 ml de solution. Par exemple, une solution de NaCl à 10 % contient 10 g de sel dans 100 ml de solution.
Technique de préparation de solutions en pourcentage à partir d'acides concentrés.
Les acides concentrés (sulfurique, chlorhydrique, nitrique) contiennent de l'eau. Le rapport entre l'acide et l'eau qu'ils contiennent est indiqué en pourcentages pondéraux.
La densité des solutions est dans la plupart des cas supérieure à l'unité. Le pourcentage d'acides est déterminé par leur densité. Lors de la préparation de solutions plus diluées à partir de solutions concentrées, leur teneur en eau est prise en compte.
Exemple. Il est nécessaire de préparer une solution à 20 % d'acide sulfurique H 2 SO 4 à partir d'acide sulfurique concentré à 98 % avec une densité D = 1,84 g/ml. Dans un premier temps, nous calculons quelle quantité de solution concentrée contient 20 g d'acide sulfurique.
100 – 98 X = (20*100) / 98 = 20,4 g
En pratique, il est plus pratique de travailler avec des unités d’acides volumétriques plutôt qu’en poids. Par conséquent, ils calculent quel volume d’acide concentré occupe le poids requis de la substance. Pour ce faire, le nombre obtenu en grammes est divisé par l'indicateur de densité.
V = M/P = 20,4 / 1,84 = 11 ml
Elle peut être calculée d'une autre manière, lorsque la concentration de la solution acide initiale est immédiatement exprimée en pourcentages poids-volume.
100 – 180 X = 11 ml
Lorsqu'une précision particulière n'est pas requise, lors de la dilution des solutions ou de leur mélange pour obtenir des solutions de concentration différente, vous pouvez utiliser la méthode simple et rapide suivante. Par exemple, vous devez préparer une solution à 5 % de sulfate d'ammonium à partir d'une solution à 20 %.
Où 20 est la concentration de la solution prélevée, 0 est l'eau et 5 est la concentration requise. Nous soustrayons 5 de 20 et écrivons la valeur résultante dans le coin inférieur droit, en soustrayant 0 de 5, écrivons le nombre dans le coin supérieur droit. Le schéma prendra alors la forme suivante.
Cela signifie que vous devez prendre 5 parties d'une solution à 20 % et 15 parties d'eau. Si vous mélangez 2 solutions, le schéma reste le même, seule la solution originale avec une concentration plus faible est inscrite dans le coin inférieur gauche. Par exemple, en mélangeant des solutions à 30 % et à 15 %, vous devez obtenir une solution à 25 %.
Ainsi, vous devez prendre 10 parties d'une solution à 30 % et 15 parties d'une solution à 15 %. Ce schéma peut être utilisé lorsqu'une précision particulière n'est pas requise.
Les solutions précises comprennent les solutions normales, molaires et standard.
Une solution est dite normale si 1 g contient g – l’équivalent d’une substance dissoute. La quantité pondérale d’une substance complexe, exprimée en grammes et numériquement égale à son équivalent, est appelée équivalent-gramme. Lors du calcul des équivalents de composés tels que les bases, les acides et les sels, vous pouvez utiliser les règles suivantes.
1. L'équivalent de base (E o) est égal au poids moléculaire de la base divisé par le nombre de groupes OH dans sa molécule (ou par la valence du métal).
E(NaOH) = 40/1 = 40
2. L'équivalent acide (Ek) est égal au poids moléculaire de l'acide divisé par le nombre d'atomes d'hydrogène dans sa molécule qui peuvent être remplacés par le métal.
E(H 2 SO 4) = 98/2 = 49
E(HCl) = 36,5/1=36,5
3. L'équivalent sel (E s) est égal au poids moléculaire du sel divisé par le produit de la valence du métal et du nombre de ses atomes.
E(NaCl) = 58,5/(1*1) = 58,5
Lorsque les acides et les bases interagissent, en fonction des propriétés des substances en réaction et des conditions de réaction, tous les atomes d'hydrogène présents dans la molécule d'acide ne sont pas nécessairement remplacés par un atome métallique et des sels d'acide se forment. Dans ces cas, l’équivalent-gramme est déterminé par le nombre d’atomes d’hydrogène remplacés par des atomes de métal dans une réaction donnée.
H 3 PO 4 + NaOH = NaH 2 PO + H 2 O (l'équivalent gramme est égal au poids moléculaire en gramme).
H 3 PO 4 + 2NaOH = Na 2 HPO 4 + 2H 2 O (l'équivalent en gramme est égal à un demi-gramme de poids moléculaire).
Lors de la détermination de l'équivalent en grammes, des connaissances sont requises réaction chimique et les conditions dans lesquelles cela se produit. Si vous devez préparer des solutions décinormales, centinormales ou millinormales, prenez respectivement 0,1 ; 0,01 ; 0,001 gramme est l'équivalent de la substance. Connaissant la normalité de la solution N et du soluté équivalent E, il est facile de calculer combien de grammes de substance sont contenus dans 1 ml de solution. Pour ce faire, vous devez diviser la masse de la substance dissoute par 1000. La quantité de substance dissoute en grammes contenue dans 1 ml de solution est appelée titre de la solution (T).
T = (N*E) / 1000
T (0,1 H 2 SO 4) = (0,1 * 49) / 1000 = 0,0049 g/ml.
Une solution dont le titre (concentration) est connu est dite titrée. À l'aide d'une solution alcaline titrée, vous pouvez déterminer la concentration (normalité) d'une solution acide (acidimétrie). À l'aide d'une solution acide titrée, vous pouvez déterminer la concentration (normalité) d'une solution alcaline (alcalimétrie). Les solutions de même normalité réagissent en volumes égaux. À différentes normalités, ces solutions réagissent entre elles dans des volumes inversement proportionnels à leurs normalités.
N k / N sh = V sh / V k
Nk * Vk = Nsch * Vsch
Exemple. Pour titrer 10 ml de solution de HCl, 15 ml de solution de NaOH 0,5 N ont été utilisés. Calculez la normalité de la solution de HCl.
Nk * 10 = 0,5 * 15
Nk = (0,5 * 15) / 10 = 0,75
N=30/58,5=0,5
Les Fixanals sont pré-préparés et scellés dans des ampoules, des quantités précisément pesées de réactif nécessaires pour préparer 1 litre de solution 0,1 N ou 0,01 N. Les Fixanales se présentent sous forme liquide et sèche. Les secs ont une durée de conservation plus longue. La technique de préparation des solutions à partir de fixanals est décrite dans l'annexe à la boîte des fixanals.
Préparation et test de solutions décinormales.
Les solutions décinormales, qui sont souvent utilisées comme matières premières en laboratoire, sont préparées à partir de préparations chimiquement courantes. L'échantillon requis est pesé sur une balance chimique technique ou une balance pharmaceutique. Lors de la pesée, une erreur de 0,01 à 0,03 g est autorisée. En pratique, vous pouvez commettre une erreur en augmentant légèrement le poids calculé. L'échantillon est transféré dans une fiole jaugée, où une petite quantité d'eau est ajoutée. Une fois la substance complètement dissoute et la température de la solution égalisée avec la température de l'air, le ballon est rempli d'eau jusqu'au trait.
La solution préparée nécessite une vérification. Le test est réalisé à partir de solutions préparées à partir de leurs fixateurs, en présence d'indicateurs, et le facteur de correction (K) et le titre sont établis. Le facteur de correction (K) ou facteur de correction (F) indique quelle quantité (en ml) d'une solution normale exacte correspond à 1 ml d'une solution donnée (préparée). Pour ce faire, transférez 5 ou 10 ml de la solution préparée dans une fiole conique, ajoutez quelques gouttes d'indicateur et titrez avec la solution exacte. Le titrage est effectué deux fois et la moyenne arithmétique est calculée. Les résultats du titrage doivent être approximativement les mêmes (différence inférieure à 0,2 ml). Le facteur de correction est calculé sur la base du rapport entre le volume de la solution exacte Vt et le volume de la solution test Vn.
K = Vt / Vn.
Le facteur de correction peut également être déterminé d'une deuxième manière - par le rapport du titre de la solution à tester au titre théoriquement calculé de la solution exacte.
K = T pratique /T théorie.
Si les côtés gauches d’une équation sont égaux, alors leurs côtés droits sont égaux.
V t / V n. = T pratique /T théorie.
Si le titre pratique de la solution à tester est trouvé, la teneur pondérale de la substance dans 1 ml de solution a été déterminée. Lorsque la solution exacte et la solution testée interagissent, 3 cas peuvent se produire.
1. Les solutions ont interagi en volumes égaux. Par exemple, le titrage de 10 ml d’une solution 0,1 N nécessite 10 ml de solution à tester. La normalité est donc la même et le facteur de correction est égal à un.
2. 9,5 ml de la solution d'essai ont été utilisés pour interagir avec 10 ml de la solution exacte ; la solution d'essai s'est avérée plus concentrée que la solution exacte.
3. 10,5 ml de la solution d'essai ont été utilisés pour interagir avec 10 ml de la solution exacte ; la concentration de la solution d'essai est plus faible que celle de la solution exacte.
Le facteur de correction est calculé à la deuxième décimale près ; des fluctuations de 0,95 à 1,05 sont autorisées.
Correction des solutions dont le facteur de correction est supérieur à un.
Le facteur de correction montre combien de fois une solution donnée est plus concentrée qu'une solution d'une certaine normalité. Par exemple, K vaut 1,06. Par conséquent, 0,06 ml d’eau doit être ajouté à chaque ml de solution préparée. S'il reste 200 ml de solution, alors (0,06*200) = 12 ml - ajouter à la solution préparée restante et mélanger. Cette méthode pour amener des solutions à une certaine normalité est simple et pratique. Lorsque vous préparez des solutions, vous devez les préparer avec des solutions plus concentrées plutôt qu’avec des solutions diluées.
Préparation de solutions précises dont le facteur de correction est inférieur à un.
Dans ces solutions, il manque une partie de l’équivalent gramme. Cette pièce manquante peut être identifiée. Si vous calculez la différence entre le titre d'une solution d'une certaine normalité (titre théorique) et le titre d'une solution donnée. La valeur résultante montre la quantité de substance qui doit être ajoutée à 1 ml de solution pour l'amener à la concentration de solution d'une normalité donnée.
Exemple. Le facteur de correction pour une solution d'hydroxyde de sodium environ 0,1 N est de 0,9, le volume de la solution est de 1000 ml. Amener la solution à une concentration exactement de 0,1 N. Equivalent en grammes d'hydroxyde de sodium – 40 g Titre théorique pour une solution 0,1 N – 0,004. Titre pratique - Théorie T. * K = 0,004 * 0,9 = 0,0036 g.
Théorie T. - Je m'entraîne. = 0,004 – 0,0036 = 0,0004 g.
1000 ml de solution sont restés inutilisés - 1000 * 0,0004 = 0,4 g.
La quantité résultante de la substance est ajoutée à la solution, bien mélangée et le titre de la solution est à nouveau déterminé. Si la matière première pour la préparation des solutions est constituée d'acides concentrés, d'alcalis et d'autres substances, il est alors nécessaire d'effectuer un calcul supplémentaire pour déterminer quelle quantité de solution concentrée contient la quantité calculée de cette substance. Exemple. Le titrage de 5 ml d'une solution de HCl environ 0,1 N nécessitait 4,3 ml d'une solution exacte de NaOH 0,1 N.
K = 4,3/5 = 0,86
La solution est faible, elle doit être renforcée. Nous calculons la théorie T. , T pratique et leur différence.
Théorie T. = 3,65 / 1000 = 0,00365
Je m'entraîne. = 0,00365 * 0,86 = 0,00314
Théorie T. - Je m'entraîne. = 0,00364 – 0,00314 = 0,00051
200 ml de solution sont restés inutilisés.
200 * 0,00051 = 0,102 g
Pour une solution de HCl à 38% avec une densité de 1,19, on constitue une proportion.
100 – 38 X = (0,102 * 100) / 38 = 0,26 g
Nous convertissons les unités de poids en unités de volume, en tenant compte de la densité de l'acide.
V = 0,26 / 1,19 = 0,21 ml
Préparation de 0,01 N, 0,005 N à partir de solutions décinormales, ayant un facteur de correction.
Dans un premier temps, calculez quel volume de solution 0,1 N doit être prélevé pour préparer à partir d’une solution 0,01 N. Le volume calculé est divisé par le facteur de correction. Exemple. Il faut préparer 100 ml de solution 0,01 N à partir de 0,1 N avec K = 1,05. Puisque la solution est 1,05 fois plus concentrée, il faut prendre 10/1,05 = 9,52 ml. Si K = 0,9, alors vous devez prendre 10/0,9 = 11,11 ml. Dans ce cas, prélever une quantité de solution légèrement plus importante et ajuster le volume de la fiole jaugée à 100 ml.
Les règles suivantes s'appliquent pour la préparation et le stockage des solutions titrées.
1. Chaque solution titrée a sa propre durée de conservation. Pendant le stockage, ils changent de titre. Lors d'une analyse, il est nécessaire de vérifier le titre de la solution.
2. Il est nécessaire de connaître les propriétés des solutions. Le titre de certaines solutions (hyposulfite de sodium) change avec le temps, leur titre est donc établi au plus tôt 5 à 7 jours après la préparation.
3. Tous les flacons contenant des solutions titrées doivent avoir une étiquette claire indiquant la substance, sa concentration, son facteur de correction, l'heure de préparation de la solution et la date du contrôle du titrage.
4. Lors du travail analytique, une grande attention doit être accordée aux calculs.
T = A / V (A – échantillon)
N = (1000 * A) / (V * g /éq)
T = (N * g/éq) / 1000
N = (T * 1000) / (g/éq)
Une solution est dite molaire si 1 litre contient 1 g*mol de soluté. La taupe est le poids moléculaire exprimé en grammes. Solution 1 molaire d'acide sulfurique - 1 litre d'une telle solution contient 98 g d'acide sulfurique. Une solution centimolaire contient 0,01 mole dans 1 litre, une solution millimolaire en contient 0,001 mole. Une solution dont la concentration est exprimée en nombre de moles pour 1000 g de solvant est appelée molal.
Par exemple, 1 litre de solution d'hydroxyde de sodium 1 M contient 40 g de médicament. 100 ml de solution contiendront 4,0 g, soit solution 4/100 ml (4g%).
Si la solution d'hydroxyde de sodium est à 60/100 (60 mg%), vous devez déterminer sa molarité. 100 ml de solution contiennent 60 g d'hydroxyde de sodium et 1 litre - 600 g, soit 1 litre de solution 1 M doit contenir 40 g d'hydroxyde de sodium. La molarité du sodium est X = 600/40 = 15 M.
Les solutions étalons sont des solutions dont les concentrations sont connues avec précision et utilisées pour la détermination quantitative de substances par colorimétrie et néphélométrie. Les échantillons de solutions étalons sont pesés sur une balance analytique. La substance à partir de laquelle la solution étalon est préparée doit être chimiquement pure. Solutions standards. Les solutions étalons sont préparées dans le volume requis pour la consommation, mais pas plus de 1 litre. La quantité de substance (en grammes) nécessaire pour obtenir des solutions étalons – A.
A = (M I * T * V) / M 2
M I – Masse moléculaire du soluté.
T – Titre de la solution pour la substance à déterminer (g/ml).
V – Régler le volume (ml).
M 2 – Masse moléculaire ou atomique de la substance à déterminer.
Exemple. Il est nécessaire de préparer 100 ml d'une solution étalon de CuSO 4 * 5H 2 O pour le dosage colorimétrique du cuivre, et 1 ml de solution doit contenir 1 mg de cuivre. Dans ce cas, MI = 249,68 ; M2 = 63,54 ; T = 0,001 g/ml ; V = 100 ml.
A = (249,68*0,001*100) / 63,54 = 0,3929 g.
Transférer un échantillon de sel dans une fiole jaugée de 100 ml et ajouter de l'eau jusqu'au trait.
Testez les questions et les tâches.
1. Qu'est-ce qu'une solution ?
2. De quelles manières existe-t-il pour exprimer la concentration des solutions ?
3. Quel est le titre de la solution ?
4. Qu'est-ce qu'un équivalent gramme et comment est-il calculé pour les acides, les sels et les bases ?
5. Comment préparer une solution 0,1 N de soude NaOH ?
6. Comment préparer une solution 0,1 N d'acide sulfurique H 2 SO 4 à partir d'acide concentré de densité 1,84 ?
8. Quelle est la méthode de renforcement et de dilution des solutions ?
9. Calculez combien de grammes de NaOH sont nécessaires pour préparer 500 ml de solution 0,1 M ? La réponse est 2 ans.
10. Combien de grammes de CuSO 4 * 5H 2 O faut-il prendre pour préparer 2 litres de solution 0,1 N ? La réponse est 25 g.
11. Pour titrer 10 ml de solution de HCl, 15 ml de solution de NaOH 0,5 N ont été utilisés. Calculer la normalité de HCl, la concentration de la solution en g/l, le titre de la solution en g/ml. La réponse est 0,75 ; 27,375 g/l ; T = 0,0274 g/ml.
12. 18 g d'une substance sont dissous dans 200 g d'eau. Calculez la concentration en pourcentage en poids de la solution. La réponse est 8,25 %.
13. Combien de ml de solution d'acide sulfurique à 96 % (D = 1,84) faut-il prendre pour préparer 500 ml de solution 0,05 N ? La réponse est 0,69 ml.
14. Titre de la solution H 2 SO 4 = 0,0049 g/ml. Calculez la normalité de cette solution. La réponse est 0,1 N.
15. Combien de grammes d'hydroxyde de sodium faut-il prendre pour préparer 300 ml de solution 0,2 N ? La réponse est 2,4 g.
16. De quelle quantité avez-vous besoin pour prendre une solution à 96 % de H 2 SO 4 (D = 1,84) pour préparer 2 litres d'une solution à 15 % ? La réponse est 168 ml.
17. Combien de ml de solution d'acide sulfurique à 96 % (D = 1,84) faut-il prendre pour préparer 500 ml de solution 0,35 N ? La réponse est 9,3 ml.
18. Combien de ml d'acide sulfurique à 96 % (D = 1,84) faut-il prendre pour préparer 1 litre de solution 0,5 N ? La réponse est 13,84 ml.
19. Quelle est la molarité d'une solution d'acide chlorhydrique à 20 % (D = 1,1). La réponse est 6,03 M.
20. Calculez la concentration molaire d'une solution d'acide nitrique à 10 % (D = 1,056). La réponse est 1,68 M.
Pour préparer des solutions de concentrations molaires et normales, un échantillon de la substance est pesé sur une balance analytique et les solutions sont préparées dans une fiole jaugée. Lors de la préparation de solutions acides, le volume requis de solution acide concentrée est mesuré avec une burette munie d'un robinet en verre.
Le poids du soluté est calculé à la quatrième décimale et les poids moléculaires sont pris avec la précision avec laquelle ils sont donnés dans les tableaux de référence. Le volume d’acide concentré est calculé à la deuxième décimale près.
Exemple 1. Combien de grammes de chlorure de baryum faut-il pour préparer 2 litres de solution 0,2 M ?
Solution. Le poids moléculaire du chlorure de baryum est de 208,27. Donc. 1 litre de solution 0,2 M doit contenir 208,27-0,2 = 41,654 g de BaCl 2 . Pour préparer 2 litres il vous faudra 41,654-2 = 83,308 g de BaCl 2.
Exemple 2. Combien de grammes de soude anhydre Na 2 C0 3 sont nécessaires pour préparer 500 ml de 0,1 N. solution?
Solution. Le poids moléculaire de la soude est de 106,004 ; masse unitaire équivalente 5 N a 2 C0 3 =M : 2 = 53,002 ; 0,1 éq. = 5,3002g
1000 ml 0,1 n. la solution contient 5,3002 g Na 2 C0 3
500 »» » » » X
»Na2C03
5,3002-500
x=—— Gooo—- = 2-6501 g Na 2 C0 3.
Exemple 3. Quelle quantité d'acide sulfurique concentré (96 % : d=1,84) est nécessaire pour préparer 2 litres de 0,05 N. une solution d'acide sulfurique ?
Solution. Le poids moléculaire de l'acide sulfurique est de 98,08. Masse équivalente d'acide sulfurique 3h 2 donc 4 = M : 2 = 98,08 : 2 = 49,04 g Masse 0,05 éq. = 49,04-0,05 = 2,452 g.
Voyons combien de H 2 S0 4 doivent être contenus dans 2 litres de 0,05 n. solution:
1 litre-2,452 g H 2 S0 4
2"- X » H 2 S0 4
X = 2,452-2 = 4,904 g H 2 S0 4.
Pour déterminer quelle quantité de solution à 96,% H 2 S0 4 doit être prise pour cela, faisons une proportion :
\ dans 100 g de conc. H 2 S0 4 -96 g H 2 S0 4
U» » H 2 S0 4 -4,904 g H 2 S0 4
4,904-100
U=——— §6—— = 5,11 g H 2 S0 4 .
On recalcule cette quantité en volume : ,. R. 5,11
K = 7 = TJ = 2' 77 ml -
Ainsi, pour préparer 2 litres de 0,05 N. solution, vous devez prendre 2,77 ml d’acide sulfurique concentré.
Exemple 4. Calculez le titre d'une solution de NaOH si l'on sait que sa concentration exacte est de 0,0520 N.
Solution. Rappelons que le titre est le contenu dans 1 ml d'une solution d'une substance en grammes. Masse équivalente de NaOH = 40 01 g Voyons combien de grammes de NaOH sont contenus dans 1 litre de cette solution :
40,01-0,0520 = 2,0805 g.
1 litre de solution : -n=- =0,00208 g/ml. Vous pouvez également utiliser la formule :
9N
Où T- titre, g/ml ; E- masse équivalente ; N- normalité de la solution.
Alors le titre de cette solution est :
f 40,01 0,0520
« NaOH =——— jooo—— 0,00208 g/ml.
„ « Rie P 5 - Calculer la concentration normale de la solution HN0 3 si l'on sait que le titre de cette solution est de 0,0065. Pour calculer, on utilise la formule :
T ■ 1000 63,05
5hno 3 = j- = 63,05.
La concentration normale de la solution d’acide nitrique est :
- V = 63,05 = 0,1030 n.
Exemple 6. Quelle est la concentration normale d'une solution si l'on sait que 200 ml de cette solution contiennent 2,6501 g de Na 2 C0 3
Solution.
Comme cela a été calculé dans l'exemple 2, Zma 2 co(=53,002.
Trouvons combien d'équivalents font 2,6501 g de Na 2 C0 3 : G
2,6501 : 53,002 = 0,05 éq. /
Afin de calculer la concentration normale d'une solution, nous créons une proportion :
1000 » » X"
1000-0,05
X =
—————— =0,25 éq.
1 litre de cette solution contiendra 0,25 équivalent, c'est-à-dire que la solution sera de 0,25 N.
Pour ce calcul vous pouvez utiliser la formule :
R- 1000
Où R. - quantité de substance en grammes ; E - masse équivalente de la substance ; V - volume de solution en millilitres.
Zia 2 avec 3 = 53,002, alors la concentration normale de cette solution
2,6501-10С0 N = 53,002-200
Préparation des solutions. Une solution est un mélange homogène de deux ou plusieurs substances. La concentration d'une solution s'exprime de différentes manières :
en pourcentage en poids, c'est-à-dire par le nombre de grammes de substance contenue dans 100 g de solution ;
en pourcentage de volume, c'est-à-dire par le nombre d'unités de volume (ml) de la substance dans 100 ml de solution ;
molarité, c'est-à-dire le nombre de grammes-moles d'une substance contenue dans 1 litre de solution (solutions molaires) ;
normalité, c'est-à-dire le nombre d'équivalents-grammes de la substance dissoute dans 1 litre de solution.
Solutions de concentration en pourcentage. Les solutions en pourcentage sont préparées sous forme de solutions approximatives, tandis qu'un échantillon de la substance est pesé sur une balance technochimique et que les volumes sont mesurés à l'aide de cylindres de mesure.
Pour préparer des solutions en pourcentage, plusieurs méthodes sont utilisées.
Exemple. Il faut préparer 1 kg de solution de chlorure de sodium à 15%. Quelle quantité de sel faut-il prendre pour cela ? Le calcul s'effectue selon la proportion :
Par conséquent, pour cela, vous devez prendre 1 000 à 150 = 850 g d'eau.
Dans les cas où il est nécessaire de préparer 1 litre d'une solution de chlorure de sodium à 15 %, la quantité de sel requise est calculée de manière différente. A l'aide de l'ouvrage de référence, trouvez la densité de cette solution et, en la multipliant par un volume donné, obtenez la masse de la quantité de solution requise : 1000-1,184 = 1184 g.
Il s'ensuit alors :
Par conséquent, la quantité requise de chlorure de sodium est différente pour préparer 1 kg et 1 litre de solution. Dans les cas où des solutions sont préparées à partir de réactifs contenant de l'eau de cristallisation, cela doit être pris en compte lors du calcul de la quantité de réactif requise.
Exemple. Il faut préparer 1000 ml d'une solution à 5% de Na2CO3 d'une densité de 1,050 à partir d'un sel contenant de l'eau de cristallisation (Na2CO3-10H2O)
Le poids moléculaire (poids) de Na2CO3 est de 106 g, le poids moléculaire (poids) de Na2CO3-10H2O est de 286 g, à partir de là, la quantité requise de Na2CO3-10H2O est calculée pour préparer une solution à 5 % :
Les solutions sont préparées par dilution comme suit.
Exemple. Il est nécessaire de préparer 1 litre de solution d'HCl à 10 % à partir d'une solution acide de densité relative de 1,185 (37,3 %). La densité relative d'une solution à 10 % est de 1,047 (selon le tableau de référence), donc la masse (poids) de 1 litre d'une telle solution est de 1000X1,047 = 1047 g. Cette quantité de solution doit contenir du chlorure d'hydrogène pur.
Pour déterminer la quantité d'acide à 37,3 % qu'il faut prendre, on calcule la proportion :

Lors de la préparation de solutions en diluant ou en mélangeant deux solutions, la méthode du schéma diagonal ou la « règle du croisement » est utilisée pour simplifier les calculs. À l'intersection de deux lignes, la concentration donnée est écrite, et aux deux extrémités à gauche - la concentration des solutions initiales pour le solvant est égale à zéro ;


Dans chaque appartement de nos compatriotes, vous trouverez une petite fiole remplie de minuscules cristaux brillants de couleur gris-violet foncé. Ce produit chimique est un agent oxydant assez puissant doté de propriétés antimicrobiennes prononcées et est appelé permanganate de potassium. Les solutions de cet élément sont activement utilisées dans la vie quotidienne et dans le traitement de nombreuses pathologies. Mais les méthodes pour les préparer peuvent différer selon la concentration de la solution que l’on souhaite obtenir. Très souvent, les recettes indiquent une solution à 1 pour cent de permanganate de potassium. Comment le réaliser correctement à la maison ?
Une solution à 1% de permanganate de potassium est assez concentrée. Il ne convient pas à la consommation interne car il peut provoquer de graves brûlures. Toutefois, dans certains cas, un tel produit peut être appliqué sur la peau. Par exemple, un tel besoin peut survenir dans le traitement de maladies fongiques et de diverses formations pathologiques sur la peau - verrues, etc. De plus, un tel médicament convient au traitement des zones du corps où des escarres peuvent se former. Il a un effet irritant et desséchant local, ce qui accélère considérablement les processus de circulation sanguine et assèche l'inflammation. Certains experts conseillent d'utiliser une solution concentrée similaire pour traiter les plaies enflammées. Si l'utilisation d'une telle composition n'a pas l'effet souhaité, il peut être nécessaire d'utiliser une solution à cinq pour cent de permanganate de potassium.
Une solution à 1% de permanganate de potassium est souvent utilisée pour traiter les graines. Il s’agit de la méthode la plus courante de désinfection du matériel végétal. De plus, cette méthode se caractérise par un haut degré d'efficacité, car parmi les agents de gravure de type chimique existants, c'est le permanganate de potassium qui se caractérise par le plus grand spectre d'action.
Cependant, un pansement au permanganate de potassium ne peut garantir une désinfection à cent pour cent, car tout en éliminant de manière fiable l'infection à la surface des graines, un tel produit n'a absolument aucun effet sur les particules infectieuses à l'intérieur du matériel de plantation.
Si vous essayez d'utiliser des solutions moins concentrées et plus légères de ce produit chimique pour la gravure, elles ne donneront pas de résultat positif.
De plus, il faut tenir compte du fait que le traitement des graines collées ne sera pas non plus assez efficace. Par conséquent, avant de s'habiller, il est recommandé de bien frotter le matériel de plantation avec vos mains, en donnant à chaque graine l'accès à la solution désinfectante.
Comment préparer une solution à 1 pour cent de permanganate de potassium ?
Pour préparer un tel remède, vous aurez besoin de cristaux de permanganate de potassium et d'eau ordinaire. Si vous avez la possibilité de peser cet élément chimique, le processus de préparation d'une solution ne sera pas difficile pour vous. Il suffit de dissoudre un gramme de cristaux de permanganate de potassium dans cent millilitres d’eau.
Si vous n'avez pas la possibilité d'effectuer une pesée précise, il existe un autre moyen de préparer une solution à la concentration dont vous avez besoin.
Comme vous le savez, une cuillère à café standard a un volume de cinq millilitres. Si vous le remplissez de permanate de potassium et passez un couteau de manière à retirer la lame, vous obtiendrez exactement six grammes de cristaux. Le volume résultant du produit chimique doit être dilué dans six cents millilitres d'eau.
Une solution à 1% de permanganate de potassium a une couleur épaisse, presque noire.
Informations Complémentaires
Selon de nombreuses sources, le permanganate de potassium a une durée de conservation presque illimitée, malgré la durée de conservation officielle de seulement cinq ans. Théoriquement, ce produit chimique peut oxyder quelque chose de l’environnement s’il n’est pas stocké correctement, mais dans ce cas, les cristaux cesseront simplement de se dissoudre dans l’eau.
Il faut tenir compte du fait que les cristaux de permanganate de potassium sont extrêmement inflammables au contact d’éléments d’origine organique à oxydation rapide. De tels contacts sont non seulement source d'incendie, mais peuvent également conduire à une explosion.
Le permanganate de potassium doit être stocké exclusivement dans un endroit inaccessible à la lumière avec un niveau d'air sec suffisant (pas d'humidité élevée). Le récipient contenant ce produit chimique doit être hermétiquement couvert.
Vous ne devez en aucun cas dissoudre et conserver le permanganate de potassium dans un récipient métallique. Ce produit chimique entrera en contact avec les contenants, ce qui entraînera l'apparition de marques indélébiles sur ceux-ci et entraînera la perte de certaines qualités médicinales. Il est préférable d'utiliser des récipients en verre pour préparer les solutions.
La solution de permanganate de potassium ne conserve pas ses qualités uniques aussi longtemps - quelques heures seulement après sa préparation. Une fois que le liquide cicatrisant devient brunâtre, il ne sert tout simplement à rien de l’utiliser.
Gardez à l’esprit qu’une exposition prolongée à une solution forte de permanganate de potassium sur la peau peut provoquer de graves brûlures. Les personnes à la peau claire et sensible doivent également faire particulièrement attention. Les solutions fortes de permanganate de potassium sont extrêmement rarement utilisées en pratique pédiatrique.