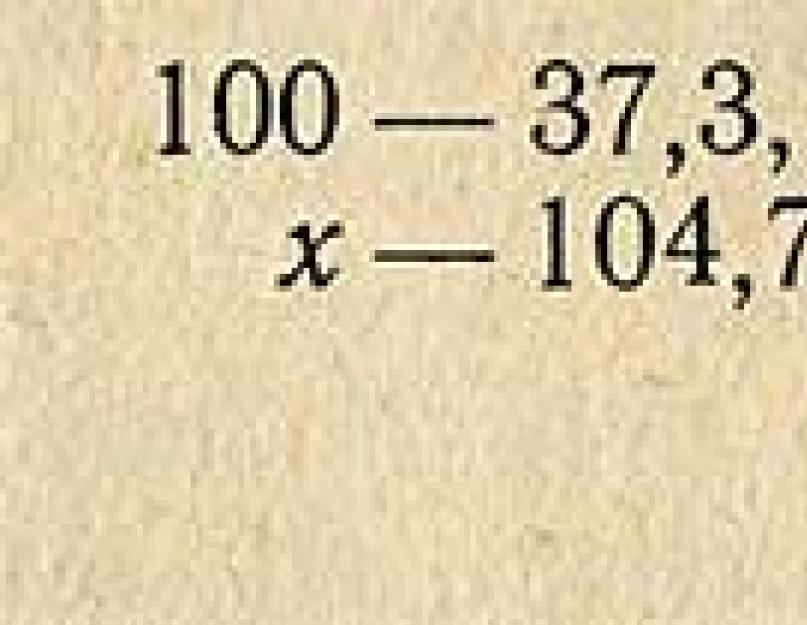Préparation des solutions. Une solution est un mélange homogène de deux ou plusieurs substances. La concentration d'une solution s'exprime de différentes manières :
en pourcentage en poids, c'est-à-dire par le nombre de grammes de substance contenue dans 100 g de solution ;
en pourcentage de volume, c'est-à-dire par le nombre d'unités de volume (ml) de la substance dans 100 ml de solution ;
molarité, c'est-à-dire le nombre de grammes-moles d'une substance contenue dans 1 litre de solution (solutions molaires) ;
normalité, c'est-à-dire le nombre d'équivalents-grammes de la substance dissoute dans 1 litre de solution.
Solutions de concentration en pourcentage. Les solutions en pourcentage sont préparées sous forme de solutions approximatives, tandis qu'un échantillon de la substance est pesé sur une balance technochimique et que les volumes sont mesurés à l'aide de cylindres de mesure.
Pour préparer des solutions pourcentages, plusieurs méthodes sont utilisées.
Exemple. Il faut préparer 1 kg de solution de chlorure de sodium à 15%. Quelle quantité de sel faut-il prendre pour cela ? Le calcul s'effectue selon la proportion :
Par conséquent, pour cela, vous devez prendre 1 000 à 150 = 850 g d'eau.
Dans les cas où il est nécessaire de préparer 1 litre de solution de chlorure de sodium à 15 %, la quantité de sel requise est calculée de manière différente. A l'aide de l'ouvrage de référence, trouvez la densité de cette solution et, en la multipliant par un volume donné, obtenez la masse de la quantité de solution requise : 1000-1,184 = 1184 g.
Il s'ensuit alors :
Par conséquent, la quantité requise de chlorure de sodium est différente pour préparer 1 kg et 1 litre de solution. Dans les cas où des solutions sont préparées à partir de réactifs contenant de l'eau de cristallisation, cela doit être pris en compte lors du calcul de la quantité de réactif requise.
Exemple. Il faut préparer 1000 ml d'une solution à 5% de Na2CO3 d'une densité de 1,050 à partir d'un sel contenant de l'eau de cristallisation (Na2CO3-10H2O)
Le poids moléculaire (poids) de Na2CO3 est de 106 g, le poids moléculaire (poids) de Na2CO3-10H2O est de 286 g, à partir de là, la quantité requise de Na2CO3-10H2O est calculée pour préparer une solution à 5 % :
Les solutions sont préparées en utilisant la méthode de dilution comme suit.
Exemple. Il est nécessaire de préparer 1 litre de solution d'HCl à 10 % à partir d'une solution acide de densité relative de 1,185 (37,3 %). La densité relative d'une solution à 10% est de 1,047 (selon le tableau de référence), donc la masse (poids) de 1 litre d'une telle solution est de 1000X1,047 = 1047 g. Cette quantité de solution doit contenir du chlorure d'hydrogène pur
Pour déterminer la quantité d'acide à 37,3 % qu'il faut prendre, on calcule la proportion :

Lors de la préparation de solutions en diluant ou en mélangeant deux solutions, la méthode du schéma diagonal ou la « règle du croisement » est utilisée pour simplifier les calculs. A l'intersection de deux lignes est écrite la concentration donnée, et aux deux extrémités à gauche - la concentration des solutions initiales ; pour le solvant elle est égale à zéro.


AGENCE FÉDÉRALE POUR L'ÉDUCATION
INSTITUT D'ÉNERGIE ATOMIQUE D'OBNINSK –
Établissement d'enseignement autonome de l'État fédéral d'enseignement professionnel supérieur
"Université Nationale de Recherche Nucléaire "MEPhI"
(IATE NRNU MEPhI)
Faculté de médecine
"APPROUVÉ"
Chef du département de thérapie
Faculté de médecine,
Professeur
_________________
N.K. Voznesensky « _____ »__________________2011
Algorithmes de diagnostic et de manipulation
pour le travail indépendant des étudiants
Préparation de solutions désinfectantes chlorées de travail. Préparation d'une solution mère d'eau de Javel à 10 %.
Finalité : respect des règles du régime sanitaire et épidémiologique dans les établissements de santé, utilisation pour la préparation de solutions de travail de diverses concentrations en vue de désinfecter les locaux, la vaisselle, les toilettes, les sécrétions des patients, etc.
Équipement : Vêtements spécialisés (robe, masque, gants de caoutchouc, respirateur, lunettes de sécurité); seau doseur en émail; spatules en bois; bouteille sombre; 1 kg d'eau de Javel sèche, 9 litres d'eau, gaze.
Technique : les vêtements spécialisés sont portés dans une pièce spécialement désignée.
Placez 1 kg d'eau de Javel sèche dans un seau émaillé et écrasez-le avec une spatule en bois pour qu'il n'y ait pas de grumeaux.
Versez 9 litres d'eau, remuez constamment, laissez la suspension obtenue dans un seau pendant une journée dans un endroit frais, fermez le seau avec un couvercle.
Après 24 heures, la solution obtenue est filtrée dans un flacon foncé muni d'un bouchon rodé et la date de préparation est notée. Le flacon contenant la solution est conservé dans un endroit frais et sombre. La solution résultante est la solution initiale (maître) à partir de laquelle les solutions de travail sont préparées (0,5 %, 1 %, 3 %, 5 %). La solution mère reste active pendant 3 jours.
Les solutions de travail sont préparées à partir de la solution mère immédiatement avant utilisation. Toutes les solutions de travail d'eau de Javel sont préparées à partir d'une solution mère à 10 % selon la formule : X = (A*B) : C, où A est la concentration de la solution requise, B est la quantité de la solution requise, C est la concentration de la solution initiale.
Préparation d'une solution de travail à 1% d'eau de Javel.
Objectif : utilisé pour la désinfection des locaux, des toilettes, des articles de soins, de la vaisselle.
Équipement : vêtements spécialisés : robe longue, casquette, tablier en toile cirée, gants médicaux, chaussures de remplacement, respirateur, lunettes de sécurité ; récipient pour solutions désinfectantes avec les marquages appropriés ; Solution d'eau de Javel clarifiée à 10 % (maître) ; récipients doseurs marqués d'une capacité de 1 litre et 10 litres (seau), eau (9 litres) ; spatule en bois.
Conditions obligatoires : la teneur en chlore actif doit correspondre à 0,25 % dans la solution préparée ; la solution est utilisée une fois ;
Préparation et exécution de la procédure :
1. Mettez des vêtements spécialisés et préparez l’équipement.
2. Vérifiez l'étiquetage de la solution mère et du seau pour la solution de travail.
3.Prenez un récipient doseur de 1 litre, versez une solution d'eau de Javel clarifiée basique à 10 % (solution principale) dans un récipient de 1 litre. Verser dans un récipient pour solution de travail à 1% (seau). Ajouter de l'eau à 10 litres. Remuez la solution avec une spatule en bois. Fermez le couvercle, vérifiez l'étiquetage, mettez la date de préparation et la signature.
4. Utiliser pour la désinfection après préparation.
5.Enlevez les vêtements spécialisés, lavez-vous les mains et essuyez-les.
Remarque : la teneur en chlore actif diminue lors d'un stockage de longue durée.
Préparation d'une solution de chloramine à 1% (1 litre).
Objectif : Utiliser pour la désinfection.
Matériel : vêtements spécialisés, un échantillon de 1 g de poudre de chloramine sèche, un récipient d'eau marqué jusqu'à 1 litre, un récipient pour solution désinfectante, une spatule en bois.
Conditions obligatoires : la teneur en chlore actif correspond à 0,25%. La solution est utilisée une fois.
Préparation et exécution de l'intervention : Enfiler des vêtements spécialisés, préparer le matériel.
2. Versez une petite quantité d'eau dans le récipient, placez un échantillon de poudre de chloramine sèche (10 g) dans le récipient, ajoutez de l'eau jusqu'au repère 1 litre, mélangez la solution avec une spatule en bois, fermez le couvercle, vérifiez les repères de le récipient et les étiquettes, mettre la date de préparation de la solution et signer.
« Diochlore : 7 comprimés pour 10 litres d'eau. Sulfochloranthine : 20 g (1 cuillère à soupe bombée) par seau d'eau.
Détermination du poids corporel du patient.
Finalité : diagnostic, étude de la condition physique d’une personne
Contre-indications : état grave du patient.
Équipement : balance médicale, toile cirée propre 30*30 cm sur le plateau de la balance, un récipient avec une solution désinfectante pour désinfecter la toile cirée et les gants, une solution de chloramine à 5 % avec une solution détergente à 0,5 %, des chiffons pour le double traitement de la toile cirée, des gants en latex.
Préparation à l'intervention : avertir le patient de l'intervention à venir, expliquer le but, les conditions de préparation. Relâchez le volet de la balance, mettez les poids de la balance en position zéro, réglez la balance, fermez le volet, posez la toile cirée désinfectée sur le plateau de la balance.
Réalisation de l'intervention : inviter le patient à se placer soigneusement au centre de la plateforme sur une toile cirée (sans chaussons). Ouvrez le volet et établissez l'équilibre en déplaçant les balances. Effectuer une pesée. Fermez le volet. Demandez au patient de descendre prudemment de la balance. Enregistrez les données de pesée sur la feuille de température. Évaluez le résultat. (Normalement, le poids corporel selon la formule de Brocca est approximativement égal à la taille moins 100). Retirez la toile cirée et traitez-la en l'essuyant deux fois avec une solution de chloramine à 5 % et une solution détergente à 0,5 %.
Lors de la préparation de solutions de concentration en pourcentage, la substance est pesée sur une balance technico-chimique et le liquide est mesuré avec un cylindre gradué. Alors accrochez-le ! les substances sont calculées avec une précision de 0,1 g et le volume de 1 liquide avec une précision de 1 ml.
Avant de commencer à préparer la solution, | il est nécessaire de faire un calcul, c'est-à-dire de calculer la quantité de soluté et de solvant pour préparer une certaine quantité d'une solution d'une concentration donnée.
CALCULS LORS DE LA PRÉPARATION DE SOLUTIONS SALINES
Exemple 1. Il faut préparer 500 g d'une solution à 5% de nitrate de potassium. 100 g d'une telle solution contiennent 5 g de KN0 3;1 On compose la proportion :
100 g de solution - 5 g KN0 3
500 » 1 - X» KN0 3
5-500 „_x= -jQg- = 25 g.
Vous devez prendre 500-25 = 475 ml d'eau.
Exemple 2. Il faut préparer 500 g d'une solution de CaCl à 5% à partir du sel CaCl 2 -6H 2 0. Tout d'abord, nous effectuons le calcul pour le sel anhydre.
100 g de solution - 5 g CaCl 2 500"" - X "CaCl 2 5-500 _ x = 100 = 25 g -
Masse molaire de CaCl 2 = 111, masse molaire de CaCl 2 - 6H 2 0 = 219*. Par conséquent, 219 g de CaC1 2 -6H 2 0 contiennent 111 g de CaC1 2. Faisons une proportion :
219 g CaC1 2 -6H 2 0-111 g CaC1 2
X » CaС1 2 -6Н 2 0- 26 » CaCI,
219-25 x = -jjj- = 49,3 g.
La quantité d'eau est de 500-49,3 = 450,7 g, soit 450,7 ml. L’eau étant mesurée à l’aide d’une éprouvette graduée, les dixièmes de millilitre ne sont pas pris en compte. Vous devez donc mesurer 451 ml d’eau.
CALCULS LORS DE LA PRÉPARATION DE SOLUTIONS ACIDES
Lors de la préparation de solutions acides, il faut tenir compte du fait que les solutions acides concentrées ne sont pas à 100 % et contiennent de l'eau. De plus, la quantité d'acide requise n'est pas pesée, mais mesurée à l'aide d'une éprouvette graduée.
Exemple 1. Il faut préparer 500 g d'une solution à 10 % d'acide chlorhydrique, sur la base de l'acide disponible à 58 %, dont la densité est d = l,19.
1. Trouvez la quantité de chlorure d'hydrogène pur qui doit être présente dans la solution acide préparée :
100 g de solution -10 g HC1 500"" - X » NS1 500-10 * = 100 = 50 g -
* Pour calculer les solutions en pourcentage de concentration molaire, la masse est arrondie aux nombres entiers.
2. Trouvez le nombre de grammes de concentré)
acide, qui contiendra 50 g de HC1 :
100 g d'acide - 38 g HC1 X » » -50 » NS1 100 50
X gg— » = 131,6 G.
3. Trouvez le volume qu'occupe cette quantité 1
acides :
V — -— 131 ‘ 6 110 6 sch
4. La quantité de solvant (eau) est de 500 - ;
-131,6 = 368,4 g, soit 368,4 ml. Puisque la nécessaire co-
La quantité d'eau et d'acide est mesurée à l'aide d'une éprouvette graduée.
rhum, alors les dixièmes de millilitre ne sont pas pris en compte
Utah. Par conséquent, pour préparer 500 g de solution à 10%
Pour l'acide chlorhydrique, il faut prendre 111 ml d'acide chlorhydrique I
acide et 368 ml d'eau.
Exemple 2. Habituellement, lors des calculs pour la préparation d'acides, des tableaux standards sont utilisés, qui indiquent le pourcentage de la solution acide, la densité de cette solution à une certaine température et le nombre de grammes de cet acide contenu dans 1 litre d'une solution de cette concentration (voir annexe V). Dans ce cas, le calcul est simplifié. La quantité de solution acide préparée peut être calculée pour un certain volume.
Par exemple, vous devez préparer 500 ml d'une solution d'acide chlorhydrique à 10 % à base d'une solution concentrée à 38 % j. D'après les tableaux, on constate qu'une solution d'acide chlorhydrique à 10 % contient 104,7 g de HC1 dans 1 litre de solution. Nous devons préparer 500 ml, la solution doit donc contenir 104,7:2 = 52,35 g de HO.
Calculons combien vous devez prendre concentré je acides. D'après le tableau, 1 litre de HC1 concentré contient 451,6 g de HC1. On compose la proportion : 1000 ml - 451,6 g de HC1 X » -52.35 » NS1
1000-52,35 x = 451,6 = "5 ml.
La quantité d'eau est de 500-115 = 385 ml.
Par conséquent, pour préparer 500 ml d'une solution d'acide chlorhydrique à 10 %, vous devez prendre 115 ml d'une solution concentrée de HC1 et 385 ml d'eau.
Habituellement, lorsque le nom « solution » est utilisé, il s’agit de vraies solutions. Dans les vraies solutions, le soluté sous forme de molécules individuelles est réparti entre les molécules de solvant. Toutes les substances ne se dissolvent pas aussi bien dans n'importe quel liquide, c'est-à-dire La solubilité de diverses substances dans certains solvants est différente. En règle générale, la solubilité des solides augmente avec l'augmentation de la température. Ainsi, lors de la préparation de telles solutions, il est souvent nécessaire de les chauffer.
Pas plus d’une certaine quantité d’une substance donnée ne peut être dissoute dans une certaine quantité de chaque solvant. Si vous préparez une solution contenant par unité de volume la plus grande quantité d'une substance pouvant se dissoudre à une température donnée et que vous y ajoutez en plus au moins une petite quantité de substance soluble, elle restera non dissoute. Une telle solution est dite saturée.
Si vous préparez une solution concentrée presque saturée par chauffage, puis refroidissez rapidement mais soigneusement la solution obtenue, un précipité peut ne pas se former. Si vous jetez un cristal de sel dans une telle solution et que vous le remuez ou le frottez avec une tige de verre contre les parois du récipient, des cristaux de sel tomberont de la solution. Par conséquent, la solution refroidie contenait plus de sel que ne correspondait sa solubilité à une température donnée. De telles solutions sont dites sursaturées.
Les propriétés des solutions diffèrent toujours des propriétés du solvant. La solution bout à une température plus élevée que le solvant pur. La température de solidification, au contraire, est plus basse pour les solutions que pour les solvants.
En fonction de la nature du solvant prélevé, les solutions sont divisées en solutions aqueuses et non aqueuses. Ces derniers comprennent des solutions de substances dans des solvants organiques (alcool, acétone, benzène, chloroforme, etc.). Le solvant de la plupart des sels, acides et alcalis est l’eau. Les biochimistes utilisent rarement de telles solutions, ils travaillent souvent avec des solutions aqueuses de substances.
Dans chaque solution, la teneur en substance est différente, il est donc important de connaître la composition quantitative de la solution. Exister différentes manières d'exprimer la concentration des solutions: en fractions massiques de la substance dissoute, moles pour 1 litre de solution, équivalents pour 1 litre de solution, grammes ou milligrammes pour 1 ml de solution, etc.
La fraction massique de la substance dissoute est déterminée en pourcentage. Ces solutions sont donc appelées solutions en pourcentage.
La fraction massique du soluté (ω) exprime le rapport de la masse du soluté (m 1) à la masse totale de la solution (m).
ω = (m 1 /m) x 100 %
La fraction massique de la substance dissoute est généralement exprimée pour 100 g de solution. Par conséquent, une solution à 10 % contient 10 g de substance pour 100 g de solution ou 10 g de substance et 100-10 = 90 g de solvant.
Concentration molaire est déterminé par le nombre de moles d'une substance dans 1 litre de solution. La concentration molaire d'une solution (M) est le rapport de la quantité de substance dissoute en moles (ν) à un certain volume de cette solution (V).
Le volume de solution est généralement exprimé en litres. Dans les laboratoires, la valeur de la concentration molaire est généralement désignée par la lettre M. Ainsi, une solution monomolaire est notée 1 M (1 mol/l), une solution décimolaire - 0,1 M (0,1 mol/l), etc. Afin de déterminer combien de grammes d'une substance donnée se trouvent dans 1 litre d'une solution d'une concentration donnée, il est nécessaire de connaître sa masse molaire (voir tableau périodique). On sait que la masse de 1 mole d'une substance est numériquement égale à sa masse molaire, par exemple, la masse molaire du chlorure de sodium est de 58,45 g/mol, donc la masse de 1 mole de NaCl est égale à 58,45 g. Ainsi, une solution de NaCl 1 M contient 58,45 g de chlorure de sodium dans 1 litre de solution.
Concentration molaire équivalente(concentration normale) est déterminée par le nombre d'équivalents de la substance dissoute dans 1 litre de solution.
Examinons la notion d'« équivalent ». Par exemple, HCl contient 1 mole d’hydrogène atomique et 1 mole de chlore atomique. On peut dire que 1 mole de chlore atomique équivaut (ou équivalent) à 1 mole d'hydrogène atomique, ou que l'équivalent de chlore dans le composé HCl est de 1 mole.
Le zinc ne se combine pas avec l'hydrogène, mais le déplace d'un certain nombre d'acides :
Zn + 2HC1 = Zn C1 2 + H 2
D’après l’équation de réaction, il ressort clairement que 1 mole de zinc remplace 2 moles d’hydrogène atomique dans l’acide chlorhydrique. Par conséquent, 0,5 mole de zinc équivaut à 1 mole d’hydrogène atomique, ou l’équivalent zinc pour cette réaction sera de 0,5 mole.
Les composés complexes peuvent également être équivalents, par exemple dans la réaction :
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O
1 mole d'acide sulfurique réagit avec 2 moles d'hydroxyde de sodium. Il s'ensuit que 1 mole d'hydroxyde de sodium équivaut dans cette réaction à 0,5 mole d'acide sulfurique.
Il faut se rappeler que dans toute réaction, les substances réagissent en quantités équivalentes. Pour préparer des solutions contenant un certain nombre d'équivalents d'une substance donnée, il faut pouvoir calculer la masse molaire de l'équivalent (masse équivalente), c'est-à-dire la masse d'un équivalent. L'équivalent (et donc la masse équivalente) n'est pas une valeur constante pour un composé donné, mais dépend du type de réaction dans laquelle entre le composé.
Masse équivalente d'acideégale à sa masse molaire divisée par la basicité de l'acide. Ainsi, pour l'acide nitrique HNO 3 la masse équivalente est égale à sa masse molaire. Pour l'acide sulfurique, la masse équivalente est de 98 : 2 = 49. Pour l'acide phosphorique tribasique, la masse équivalente est de 98 : 3 = 32,6.
De cette façon, la masse équivalente aux réactions est calculée échange complet ou neutralisation complète. Pour les réactions neutralisation incomplète et échange incomplet la masse équivalente d'une substance dépend du déroulement de la réaction.
Par exemple, en réaction :
NaOH + H 2 SO 4 = NaHSO 4 + H 2 O
1 mole d'hydroxyde de sodium équivaut à 1 mole d'acide sulfurique, donc dans cette réaction la masse équivalente d'acide sulfurique est égale à sa masse molaire, soit 98 g.
Masse de base équivalenteégale à sa masse molaire divisée par l'état d'oxydation du métal. Par exemple, la masse équivalente de l'hydroxyde de sodium NaOH est égale à sa masse molaire, et la masse équivalente de l'hydroxyde de magnésium Mg(OH) 2 est égale à 58,32:2 == 29,16 g. C'est ainsi que la masse équivalente est calculée uniquement pour la réaction neutralisation complète. Pour réaction neutralisation incomplète cette valeur dépendra également du déroulement de la réaction.
Masse équivalente de selégale à la masse molaire du sel divisée par le produit de l'état d'oxydation du métal et du nombre de ses atomes dans la molécule de sel. Ainsi la masse équivalente de sulfate de sodium est égale à 142 : (1x2) = 71 g, et la masse équivalente de sulfate d'aluminium Al 2 (SO 4) 3 est égale à 342 : (3x2) = 57 g. Cependant, si le sel est impliqué dans une réaction d'échange incomplète, alors seul le nombre d'atomes métalliques participant à la réaction est pris en compte.
Masse équivalente d'une substance participant à une réaction redox, est égal à la masse molaire d'une substance divisée par le nombre d'électrons acceptés ou cédés par une substance donnée. Par conséquent, avant de faire des calculs, il est nécessaire d'écrire l'équation de réaction :
2CuSO 4 + 4KI = 2CuI + I 2 + 2K 2 SO 4
Cu 2+ + e - à Cu +
Je - - e - à I o
La masse équivalente de CuSO 4 est égale à la masse molaire (160 g). Dans la pratique de laboratoire, on utilise le nom «concentration normale», qui est désignée dans diverses formules par la lettre N, et lorsque la concentration d'une solution donnée est désignée par la lettre «n». Une solution contenant 1 équivalent dans 1 litre de solution est appelée une normale et est désignée 1 N, contenant 0,1 équivalent - décinormal (0,1 N), 0,01 équivalent - centinormal (0,01 N).
Le titre d'une solution est le nombre de grammes d'une substance dissoute dans 1 ml de solution. Dans le laboratoire d'analyse, la concentration des solutions de travail est recalculée directement en fonction de la substance à déterminer. Ensuite, le titre de la solution indique combien de grammes de la substance à déterminer correspondent à 1 ml de la solution de travail.
La concentration des solutions utilisées en photométrie de ce qu'on appelle solutions standards, sont généralement exprimés en nombre de milligrammes dans 1 ml de solution.
Lors de la préparation de solutions acides une concentration de 1:x est souvent utilisée, indiquant combien de parties en volume d'eau (X) il y a par partie d'acide concentré.
Pour approximer des solutions Il s'agit notamment de solutions dont la concentration est exprimée en pourcentage, ainsi que de solutions d'acides dont la concentration est indiquée par l'expression 1:x. Avant de préparer des solutions, préparez des plats pour les préparer et les conserver. Si vous préparez une petite quantité de solution qui sera utilisée pendant la journée, il n'est pas nécessaire de la verser dans une bouteille, mais peut être laissée dans le flacon.
Sur le ballon il faut écrire avec un crayon de cire spécial (ou marqueur) la formule du soluté et la concentration de la solution, par exemple HC1 (5%). Lors d'un stockage à long terme, une étiquette doit être apposée sur le flacon dans lequel la solution sera conservée, indiquant quelle solution elle contient et quand elle a été préparée.
Les plats destinés à préparer et à conserver les solutions doivent être lavés et rincés à l'eau distillée.
Pour préparer des solutions, seules des substances pures et de l'eau distillée doivent être utilisées. Avant de préparer la solution, il est nécessaire de calculer la quantité de soluté et la quantité de solvant. Lors de la préparation de solutions approximatives, la quantité de soluté est calculée au dixième près, les valeurs de poids moléculaire sont arrondies aux nombres entiers et lors du calcul de la quantité de liquide, les fractions de millilitre ne sont pas prises en compte.
La technique de préparation de solutions de diverses substances est différente. Cependant, lors de la préparation d'une solution approximative, un échantillon est prélevé sur une balance technochimique et les liquides sont mesurés avec un cylindre gradué.
Préparation de solutions salines. Vous devez préparer 200 g d'une solution à 10 % de nitrate de potassium KNO3.
La quantité de sel nécessaire est calculée en fonction de la proportion :
100 g - 10 g KNO3
200 g - X g KNO 3 X = (200 x 10) / 100 = 20 g KNO 3
Quantité d'eau : 200-20=180 g ou 180 ml.
Si le sel à partir duquel la solution est préparée est contient de l'eau de cristallisation, alors le calcul sera légèrement différent. Par exemple, vous devez préparer 200 g d'une solution de CaCl 2 à 5 % à base de CaCl 2 x 6H 2 O.
Tout d'abord, le calcul est effectué pour le sel anhydre :
100 g - 5 g CaCl2
200 g - X g CaCl 2 X = 10 g CaCl 2
Le poids moléculaire de CaCl 2 est de 111, le poids moléculaire de CaCl 2 x 6H 2 O est de 219, donc 219 g de CaCl 2 x 6H 2 O contiennent 111 g de CaCl 2.
Ceux. 219 - 111
X - 10 X = 19,7 g CaCl2 x 6H 2 O
Pour obtenir la solution souhaitée, il faut peser 19,7 g de sel CaCl 2 x 6H 2 O. La quantité d'eau est de 200-19,7 = 180,3 g, soit 180,3 ml. L'eau est mesurée à l'aide d'une éprouvette graduée, les dixièmes de millimètre ne sont donc pas pris en compte. Par conséquent, vous devez prendre 180 ml d’eau.
La solution saline est préparée comme suit. La quantité de sel requise est pesée sur une balance chimique technique. Transférez soigneusement l'échantillon dans un flacon ou un verre où la solution sera préparée. Mesurez la quantité d'eau requise avec une éprouvette graduée et versez environ la moitié de la quantité mesurée dans un flacon contenant un échantillon d'eau. En remuant vigoureusement, on obtient une dissolution complète de l'échantillon, ce qui nécessite parfois un chauffage. Après avoir dissous l'échantillon, ajoutez la quantité d'eau restante. Si la solution est trouble, elle est filtrée sur un filtre plié.
Préparation de solutions alcalines. Le calcul de la quantité d'alcali nécessaire pour préparer une solution d'une concentration donnée s'effectue de la même manière que pour les solutions salines. Cependant, les alcalis solides, particulièrement peu purifiés, contiennent de nombreuses impuretés, il est donc recommandé de peser l'alcali en quantité supérieure de 2 à 3 % à la quantité calculée. La technique de préparation de solutions alcalines a ses propres caractéristiques.
Lors de la préparation de solutions alcalines, les règles suivantes doivent être respectées :
1. Les morceaux d'alcali doivent être pris avec des pinces, des pincettes, et si vous devez les prendre avec vos mains, assurez-vous de porter des gants en caoutchouc. L'alcali granulé sous forme de petits gâteaux est versé avec une cuillère en porcelaine.
2. Vous ne pouvez pas peser la lessive sur papier ; Pour cela, vous ne devez utiliser que des plats en verre ou en porcelaine.
3. L'alcali ne peut pas être dissous dans des bouteilles à parois épaisses, car lors de la dissolution, la solution devient très chaude ; la bouteille peut éclater.
La quantité d'alcali pesée sur une balance technochimique est placée dans une grande tasse ou un verre en porcelaine. Une telle quantité d'eau est versée dans ce récipient pour que la solution ait une concentration de 35 à 40 %. Remuez la solution avec une tige de verre jusqu'à ce que tout l'alcali soit dissous. Ensuite, la solution est laissée au repos jusqu'à ce qu'elle refroidisse et qu'un précipité se forme. Le précipité est constitué d'impuretés (principalement des carbonates) qui ne se dissolvent pas dans les solutions alcalines concentrées. L'alcali restant est soigneusement versé dans un autre récipient (de préférence à l'aide d'un siphon), où la quantité d'eau requise est ajoutée.
Préparation de solutions acides. Les calculs pour la préparation de solutions acides sont différents de ceux pour la préparation de solutions de sels et d'alcalis, car la concentration des solutions acides n'est pas de 100 % en raison de la teneur en eau ; La quantité d'acide requise n'est pas pesée, mais mesurée à l'aide d'une éprouvette graduée. Lors du calcul des solutions acides, des tableaux standards sont utilisés, qui indiquent le pourcentage de la solution acide, la densité de cette solution à une certaine température et la quantité de cet acide contenue dans 1 litre d'une solution d'une concentration donnée.
Par exemple, vous devez préparer 1 litre de solution de HCl à 10 % sur la base de l'acide disponible à 38,0 % avec une densité de 1,19. D'après le tableau, on constate qu'une solution acide à 10 % à température ambiante a une densité de 1,05, donc la masse de 1 litre est égale à 1,05 x 1000 == 1050 g.
Pour cette quantité, la teneur en HCl pur est calculée :
100 g - 10 g HCl
1050 g - X g HCl X = 105 g HCl
Un acide ayant une densité de 1,19 contient 38 g de HCl, donc :
X = 276 g ou 276 : 1,19 = 232 ml.
Quantité d'eau : 1000 ml - 232 ml = 768 ml.
Des solutions acides sont souvent utilisées dont la concentration est exprimée 1:x, où x est un nombre entier indiquant combien de volumes d'eau doivent être prélevés par volume d'acide concentré. Par exemple, une solution acide 1:5 signifie que lors de la préparation de la solution, 5 volumes d'eau ont été mélangés avec 1 volume d'acide concentré.
Par exemple, préparez 1 litre de solution d'acide sulfurique 1:7. Il y aura 8 parties au total. Chaque partie est égale à 1000:8 = 125 ml. Par conséquent, vous devez prendre 125 ml d’acide concentré et 875 ml d’eau.
Lors de la préparation de solutions acides, les règles suivantes doivent être respectées :
1. La solution ne peut pas être préparée dans une bouteille à paroi épaisse, car lors de la dilution des acides, en particulier de l'acide sulfurique, un fort échauffement se produit. Les solutions acides sont préparées dans des flacons.
2. Lors de la dilution, ne versez pas d'eau dans l'acide. La quantité d'eau calculée est versée dans le ballon, puis la quantité requise d'acide est ajoutée en un mince filet, progressivement, sous agitation. L'acide et l'eau sont mesurés à l'aide d'éprouvettes graduées.
3. Une fois la solution refroidie, versez-la dans une bouteille et collez une étiquette ; l'étiquette en papier est cirée ; Vous pouvez réaliser une étiquette avec une peinture spéciale directement sur les bouteilles.
4. Si l'acide concentré à partir duquel la solution diluée sera préparée est conservé pendant une longue période, il est alors nécessaire de clarifier sa concentration. Pour ce faire, mesurez sa densité et utilisez le tableau pour connaître la teneur exacte en acide de la solution.
Concentration de solutions précises exprimé en concentration ou titre molaire ou normal. Ces solutions sont généralement utilisées dans les travaux analytiques ; Ils sont rarement utilisés dans les études physicochimiques et biochimiques.
Les poids pour la préparation de solutions précises sont calculés avec une précision allant jusqu'à la quatrième décimale, et la précision des masses moléculaires correspond à la précision avec laquelle elles sont indiquées dans les tableaux de référence. L'échantillon est prélevé sur une balance analytique ; la solution est préparée dans une fiole jaugée, c'est-à-dire que la quantité de solvant n'est pas calculée. Les solutions préparées ne doivent pas être conservées dans des fioles jaugées, elles sont versées dans un flacon muni d'un bouchon bien choisi.
Si la solution exacte doit être versée dans une bouteille ou un autre flacon, procédez comme suit. La bouteille ou le flacon dans lequel la solution sera versée est soigneusement lavé, rincé plusieurs fois avec de l'eau distillée et laissé à l'envers pour égoutter l'eau, ou séché. Rincez le flacon 2 à 3 fois avec de petites portions de la solution que vous allez verser, puis versez la solution elle-même. Chaque solution précise a sa propre durée de conservation.
Calculs de cuisson les solutions molaires et normales sont réalisées comme suit.
Exemple 1.
Il est nécessaire de préparer 2 litres de solution 0,5 M Na 2 CO 3. La masse molaire de Na 2 CO 3 est de 106. Ainsi, 1 litre de solution 0,5 M contient 53 g de Na 2 CO 3. Pour préparer 2 litres il faut prendre 53 x 2 = 106 g Na 2 CO 3. Cette quantité de sel sera contenue dans 2 litres de solution.
Une autre façon de visualiser le calcul :
1 litre de solution 1M Na 2 CO 3 contient 106 g de Na 2 CO 3
(1L - 1M - 106g)
2 l de solution 1M Na 2 CO 3 contiennent x g Na 2 CO 3
(2L-1M-xg);
en comptant, « la main ferme » la partie centrale de l’expression (1M)
On constate que 2 litres de solution 1M Na 2 CO 3 contiennent 212 g de Na 2 CO 3
(2L - 1M - 212g)
Et 2 litres de solution 0,5M Na 2 CO 3 (« le côté gauche se ferme ») contiennent x g Na 2 CO 3 (2 l - 0,5 M - x g)
Ceux. 2 l de solution 0,5M Na 2 CO 3 contiennent 106 g de Na 2 CO 3
(2 L – 0,5 M – 106 g).
(obtenir une solution moins concentrée à partir d'une solution plus concentrée)
1 action :
Nombre de ml d'une solution plus concentrée (qui doit être diluée)
Volume requis en ml (à préparer)
Concentration de la solution la moins concentrée (celle que vous souhaitez obtenir)
Concentration d'une solution plus concentrée (celle que l'on dilue)
Action 2 :
Nombre de ml d'eau (ou de diluant) = ou d'eau jusqu'à (ad) volume requis ()
Tâche n°6. Un flacon d'ampicilline contient 0,5 médicament sec. Quelle quantité de solvant faut-il prendre pour que 0,5 ml de solution contienne 0,1 g de matière sèche ?
Solution: lors de la dilution de l'antibiotique pour 0,1 g de poudre sèche, prendre 0,5 ml de solvant, donc si,
0,1 g de matière sèche – 0,5 ml de solvant
0,5 g de matière sèche - x ml de solvant
on a:

Répondre: Pour que 0,5 ml de solution contienne 0,1 g de matière sèche, il faut prélever 2,5 ml de solvant.
Tâche n°7. Un flacon de pénicilline contient 1 million d'unités de médicament sec. Quelle quantité de solvant faut-il prendre pour que 0,5 ml de solution contienne 100 000 unités de matière sèche ?
Solution: 100 000 unités de matière sèche – 0,5 ml de matière sèche, puis 100 000 unités de matière sèche – 0,5 ml de matière sèche.
1 000 000 unités – x
![]()
Répondre: Pour que 0,5 ml de solution contienne 100 000 unités de matière sèche, il faut prélever 5 ml de solvant.
Tâche n°8. Un flacon d'oxacilline contient 0,25 médicament sec. Quelle quantité de solvant faut-il prendre pour que 1 ml de solution contienne 0,1 g de matière sèche ?
Solution:
1 ml de solution – 0,1 g
x ml - 0,25 g
![]()
Répondre: Pour que 1 ml de solution contienne 0,1 g de substance sèche, vous devez prendre 2,5 ml de solvant.
Problème n°9. Le prix pour diviser une seringue à insuline est de 4 unités. Combien de divisions de la seringue correspondent à 28 unités ? insuline? 36 unités ? 52 unités ?
Solution: Afin de savoir à combien de divisions de la seringue correspondent 28 unités. insuline requise : 28:4 = 7 (divisions).
Similaire : 36:4=9 (divisions)
52:4=13(divisions)
Répondre: 7, 9, 13 divisions.
Problème n°10. De quelle quantité avez-vous besoin pour prendre une solution à 10 % d'eau de Javel clarifiée et d'eau (en litres) pour préparer 10 litres d'une solution à 5 %.
Solution:
1) 100 g – 5 g
![]() (d) substance active
(d) substance active
2) 100% – 10g
![]() (ml) solution à 10 %
(ml) solution à 10 %
3) 10 000-5 000 = 5 000 (ml) d'eau
Répondre: vous devez prendre 5 000 ml d'eau de Javel clarifiée et 5 000 ml d'eau.
Problème n°11. De quelle quantité avez-vous besoin pour prendre une solution à 10 % d'eau de Javel et d'eau pour préparer 5 litres d'une solution à 1 %.
Solution:
Puisque 100 ml contiennent 10 g de substance active,
1) 100g – 1ml
5000 ml – x
![]() (ml) substance active
(ml) substance active
2) 100 % – 10 ml
![]() 00 (ml) solution à 10 %
00 (ml) solution à 10 %
3) 5 000-500 = 4 500 (ml) d'eau.
Répondre: vous devez prendre 500 ml d'une solution à 10 % et 4 500 ml d'eau.
Problème n°12. De quelle quantité avez-vous besoin pour prendre une solution à 10 % d'eau de Javel et d'eau pour préparer 2 litres d'une solution à 0,5 %.
Solution:
Puisque 100 ml contiennent 10 ml de substance active,
1) 100 % – 0,5 ml
![]() 0 (ml) de substance active
0 (ml) de substance active
2) 100 % – 10 ml
 (ml) solution à 10 %
(ml) solution à 10 %
3) 2000-100=1900 (ml) d'eau.
Répondre: vous devez prendre 10 ml d'une solution à 10 % et 1900 ml d'eau.
Problème n°13. Quelle quantité de chloramine (substance sèche) par g et d'eau est nécessaire pour préparer 1 litre d'une solution à 3 %.
Solution:
1) 3g – 100 ml
 g
g
2) 10 000 – 300 = 9 700 ml.
Répondre: Pour préparer 10 litres d'une solution à 3%, il faut prendre 300 g de chloramine et 9 700 ml d'eau.
Problème n°14. Quelle quantité de chloramine (sèche) faut-il prendre en g et en eau pour préparer 3 litres d'une solution à 0,5%.
Solution:
Le pourcentage est la quantité de substance dans 100 ml.
1) 0,5 g – 100 ml
![]() g
g
2) 3 000 – 15 = 2 985 ml.
Répondre: pour préparer 10 litres d'une solution à 3%, vous devez prendre 15 g de chloramine et 2985 ml d'eau
Problème n°15 . Quelle quantité de chloramine (sèche) faut-il prendre en g et en eau pour préparer 5 litres d'une solution à 3%.
Solution:
Le pourcentage est la quantité de substance dans 100 ml.
1) 3 g – 100 ml
![]() g
g
2) 5 000 – 150 = 4 850 ml.
Répondre: Pour préparer 5 litres d'une solution à 3%, il faut prendre 150 g de chloramine et 4850 ml d'eau.
Problème n°16. Pour appliquer une compresse chauffante à partir d'une solution d'alcool éthylique à 40 %, vous devez prendre 50 ml. Quelle quantité d’alcool à 96 % faut-il utiliser pour appliquer une compresse chaude ?
Solution:
D'après la formule (1)
![]() ml
ml
Répondre: Pour préparer une compresse chauffante à partir d'une solution d'alcool éthylique à 96 %, vous devez en prendre 21 ml.
Problème n°17. Préparez 1 litre de solution d'eau de Javel à 1 % pour traiter les équipements à partir de 1 litre de solution mère à 10 %.
Solution: Calculez combien de ml de solution à 10 % vous devez prendre pour préparer une solution à 1 % :
10g – 1000ml
![]()
Répondre: Pour préparer 1 litre d'une solution d'eau de Javel à 1 %, vous devez prendre 100 ml d'une solution à 10 % et ajouter 900 ml d'eau.
Problème n°18. Le patient doit prendre le médicament 1 mg en poudre 4 fois par jour pendant 7 jours, puis quelle quantité de ce médicament doit être prescrite (le calcul est en grammes).
Solution: 1g = 1000mg, donc 1mg = 0,001g.
Calculez la quantité de médicaments dont le patient a besoin par jour :
4* 0,001 g = 0,004 g, donc pour 7 jours il lui faut :
7* 0,004 g = 0,028 g.
Répondre: Ce médicament doit être prescrit à 0,028 g.
Problème n°19. Le patient doit recevoir 400 000 unités de pénicilline. Bouteille de 1 million d'unités. Diluer 1:1. Combien de ml de solution faut-il prendre ?
Solution: Après dilution 1:1, 1 ml de solution contient 100 000 unités d'action. 1 flacon de pénicilline, 1 million d'unités chacune, diluée dans 10 ml de solution. Si le patient doit administrer 400 000 unités, il est alors nécessaire de prendre 4 ml de la solution obtenue.
Répondre: vous devez prendre 4 ml de la solution obtenue.
Problème n°20. Injectez au patient 24 unités d’insuline. Le prix de la division seringue est de 0,1 ml.
Solution: 1 ml d'insuline contient 40 unités d'insuline. 0,1 ml d'insuline contient 4 unités d'insuline. Pour administrer 24 unités d'insuline à un patient, vous devez prendre 0,6 ml d'insuline.